Join us you will be able to get the following rights
Get fresh academic and clinical information
Sign up for exclusive endoscopy contests and training courses
Use online training software
Watch the LIVE of academic conferences and surgery
三浦義正:上消化道早癌诊治相关临床问题解答(病例解析训练营 海外专家直通车系列)
三浦義正:上消化道早癌诊治相关临床问题解答(病例解析训练营 海外专家直通车系列)

*以下内容中所有出现的LCI指联动成像技术(LCI:Linked Color Imaging);BLI指蓝光成像技术(BLI:Blue Light Imaging);PCM指口袋法(PCM:Pocket-Creation Method)
三浦教授针对中国专家提出的上消化道早癌诊治领域的临床问题,进行了如下解答。详细解答请点击视频观看。※视频内包含活动当天的在线问答部分。
【诊断类】
问题①:是否能够通过判断/测量胃体或胃底发红程度来诊断Hp感染?
回答(要点):Hp未感染的胃体部黏膜为杏色,Hp现感染的胃体部黏膜为深红色。Hp既往感染下小弯侧黏膜被肠上皮化生所取代,呈紫色;发生萎缩的区域呈褪色调;其余的胃体部黏膜因为发生了炎症所以变为杏色。
问题②:如何在内镜下对于食管早癌的浸润深度进行判定?
回答(要点):食管癌的浸润深度无法测量。(此外胃的SM1病变,浸润深度在500μm以内,也无法在术前诊断浸润深度)。建议放大内镜下观察IPCL形态,使用食管AB分型以帮助推测浸润深度。
问题③:针对胃溃疡性病变,内镜下如何区分病变的良恶性?以及如何活检取材?
回答(要点):遇到溃疡性病变,需时常考虑其为癌的可能性,特别是Hp除菌后的溃疡需要重点注意。但是在恶性循环(Malignant cycle)下癌产生了溃疡,病变整体都发生溃疡化时,即使是放大内镜诊断还是活检诊断都会变得较为困难。如果放大内镜下在溃疡的边缘发现DL、IMVP、ISVP,则可针对该处进行靶向活检,诊断其是否为癌。如果在溃疡内取活检,则病理表现只会为坏死的组织。若存在溃疡但取活检后未发现癌,则应先使用PPI等药物治疗溃疡,然后再放大内镜观察和再次取活检。
问题④:三浦教授在演讲中提到了白光下病变漏诊率很高,那是否可以直接用LCI筛查就行,还有必要切换回白光吗?我本人就喜欢从头到尾用LCI筛查,想听听三浦教授的看法。
回答(要点):全程使用LCI进行观察的优点有很多,但也存在难以确认的肿瘤。此外,LCI是提升可视性的最主要的因素。
问题⑤:使用AI系统结合LCI模式诊断HP感染的准确率有多高?
回答(要点):目前日本医院在用的AI 系统(CAD EYE)为消化道早癌诊断AI,并无诊断Hp感染、既往感染、未感染的功能。但针对Hp感染黏膜,研究显示白光下的正确诊断率为79.5%,而LCI下为86.6%;针对Hp既往感染黏膜,白光下的正确诊断率为36.8%,而LCI下为78.9%。
【治疗类】
问题①:ESD术镜下控镜的稳定性和左手旋镜的技巧有哪些?
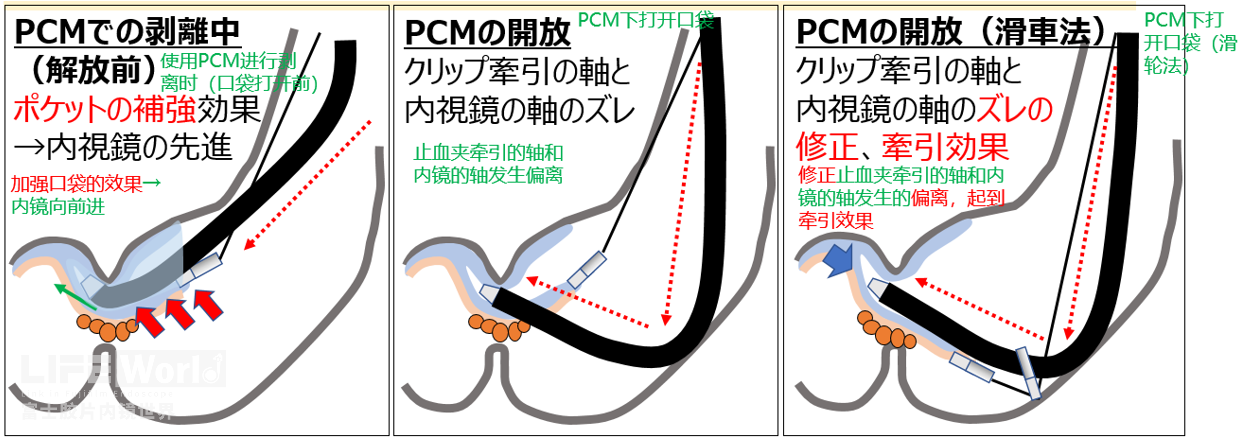
回答(要点):提升内镜稳定性的技巧为理解如何旋转镜身、左右角度旋钮;活用口袋法(Pocket-creation method);以及时常吸气,调整空气量。

问题②:做胃的ESD预切开步骤时,自己做常常不能很好地切开黏膜层,常常碰到一切就出血的情况,黏膜下层暴露不好,需要来回切好几下,请问您在预切开这一步有什么技巧吗?
回答(要点):当无法顺利进行黏膜切开时,常常是因为剥离刀和黏膜平行,很难穿透黏膜、黏膜肌层。此时需要向下打角度,用透明帽压住黏膜,通过使面前的黏膜抬起,则剥离刀穿透黏膜、黏膜肌层会更为顺利。
黏膜切开时不出血的技巧为最初通电状态下剥离刀进入黏膜下层后,稍许回拉,像钩住黏膜、黏膜肌层一样切开黏膜下层的浅层。
黏膜下层暴露困难时:
① 纤维化下导致“黏膜向内卷起的现象”→口袋法下可解决
② 内镜和黏膜接近时呈稍许垂直的方向→口袋法下可解决
③ 切开十二指肠的平坦部分时,尽量用刀鞘抬起黏膜,然后对黏膜的正下方进行修剪
问题③:食管ESD术中出血较多视野不清的情况如何处理?
回答(要点):技巧基本和胃ESD相同,在最初的黏膜切开时,避免切开较深。出血时特别是左侧部位已没于水中时,其中一个解决方法为变更为Gel immersion ESD。
问题④:牵引法具体适合胃内哪些部位做ESD?
回答(要点):我认为在任何一个部位进行牵引都是有效的。问题在于应向哪个方向进行牵引,若无牵引效果时则可使用带线的止血夹。根据情况选择对应的止血夹牵引较为重要。
问题⑤:针对ESD术后的迟发出血,可以预防性地使用哪些止血药物?以及内镜下是否有相关技巧?
回答(要点):ESD术后处理暴露的血管,能够对术后出血起到预防作用。可投用抗酸药物,对于无并发症的患者,也可P-CAB投药3周。20mg的P-CAB效果更佳(10mg的P-CAB,其效果等同于PPI)。缝合溃疡对于早期的术后出血可能有效。胃内只使用止血夹,创面很容易裂开,最好采用留置圈套器缝合,ROLM(Reopenable-clip over the line method)等新型缝合方法也可尝试。针对晚期的术后出血则尚无完全有效的预防方法。
特邀翻译专家:林香春主任(北京大学国际医院)
出处:2023年9月 病例解析训练营 海外专家直通车 在线答疑互动研讨会(本期嘉宾:三浦義正教授)
声明
富士胶片内镜世界(LIFE World)所登载的内容及其版权和使用权归作者本人与富士胶片所有。如发现会员擅自复制、更改、公开发表或其他以盈利为目的的使用,富士胶片将追究其法律责任。网站信息中涉及的治疗手技皆为术者个人针对该名患者特定体质及健康状况所采取的手法;术者对器械和药品种类的选择,也受到手术发生时间、地点等诸多因素的影响。因而相关内容及信息仅供会员参考。如盲目使用网站信息中涉及的治疗手技而发生意外,恕富士胶片及本网站对此不承担任何责任。

推荐内容
-
早癌诊疗专题2025/01/10井野裕治:自治医科大学上消化道早癌诊治经验分享
本期讲座,井野医师主要讲解了以下内容:
- LCI下鉴别肠上皮化生和胃癌的原理与实际应用
- 浸水法下实施ESD的优缺点与自治医大的改进方法
-
早癌诊疗专题2024/12/27林芳和:大肠肿瘤治疗的前沿进展
本期讲座,林教授主要讲解了以下内容:
- 内镜下肿瘤大小的评估与风险
- UEMR与ESD的对比
- MRS对ESD的影响
-
早癌诊疗专题2023/12/14三浦義正:Hp阴性时代下胃炎及胃癌的内镜下诊断
本期讲座三浦教授主要讲解了以下三个方面:
- Hp未感染胃癌的种类与好发部位
- ABC检查方法
- 自身免疫性胃炎的诊断
-
早癌诊疗专题2023/04/25林芳和:大肠诊治微课堂(四)_大肠ESD术中出血的应对方法以及血管的处理要点
本期讲座,林芳和教授分别从以下方面讲解:
- ESD术中出血引发的问题
- 容易造成ESD术中出血的因素
- 处理血管的要点
-
早癌诊疗专题2023/02/22林芳和:大肠诊治微课堂(三)_重度纤维化病变的处理方法
本期讲座,林芳和教授分别从以下方面讲解:
- 重度纤维化病变的处理难点以及容易发生纤维化的病变
- 处理重度纤维化病变的诀窍
-
早癌诊疗专题2023/02/14林芳和:锯齿状病变的诊断与治疗
本期讲座,林芳和教授主要从以下几方面讲解:
- 大肠癌的风险因素
- 第五版WHO分型对于SSL(无蒂锯齿状病变)的新定义
- 锯齿状病变的内镜下治疗标准