环扫脾脏探查(video 1)
2:线阵超声内镜脾探查的策略:
线阵型EUS进入胃腔后贴近前壁搏动处,此时显示为肝左叶,右旋转镜身约180°找到腹主动脉,循腹主动脉缓慢进镜,依次显示腹腔干(celiac trunk CT)及肠系膜上动脉(Superior Mesenteric Artery SMA)。自肠系膜上动脉稍进镜并右旋镜身,可显示胰体、尾部结构以及标准的脾动、静脉横切面。因为脾动脉走形迂曲(图1),故跟随脾静脉进一步右旋镜身并略退镜探查胰尾、左肾及左肾上腺。进一步退镜并右旋,就可探及脾脏及脾门结构。
线阵脾脏探查(video 2)
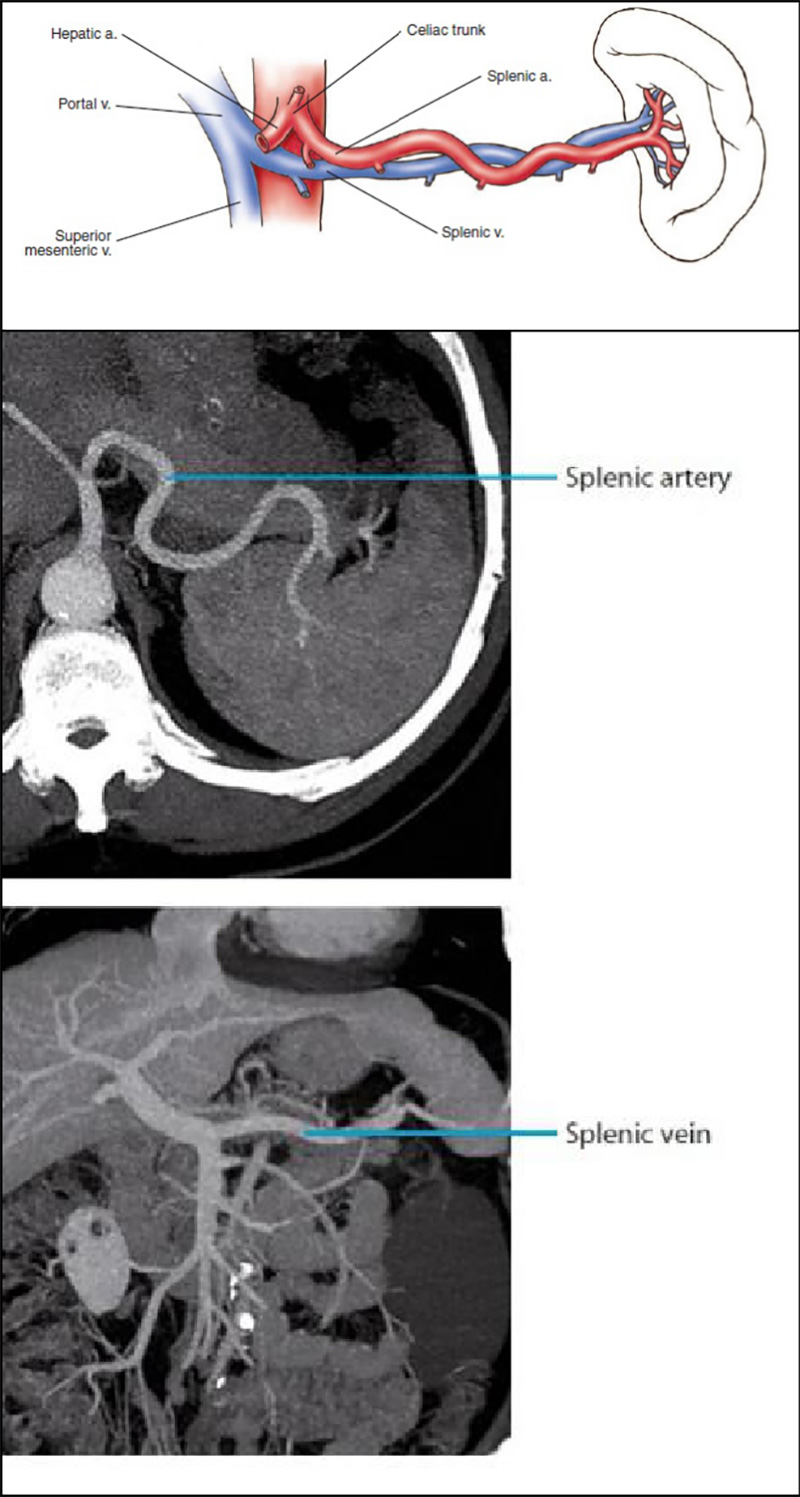
图 1 脾动脉和脾静脉
(二)脾脏疾病
脾脏原发病变包括弥漫性病变如炎症性、结核、淋巴瘤;局灶性病变如脾囊肿、淋巴瘤、血管瘤,脾梗死,恶性血管内皮肉瘤、转移癌等。脾脏病灶较沉默,缺乏明显症状,早期易漏诊、误诊。
1:脾脏多发钙化
是指脾脏局部钙盐沉积,为继发性改变,常见于脾梗死修复后、慢性炎症等。患者多无临床症状,体检时偶然发现。EUS影像表现为脾脏内点片状高回声,后方声影,当探头移动时点状高回声时隐时现,宛如星空闪烁(图2;Video3)。
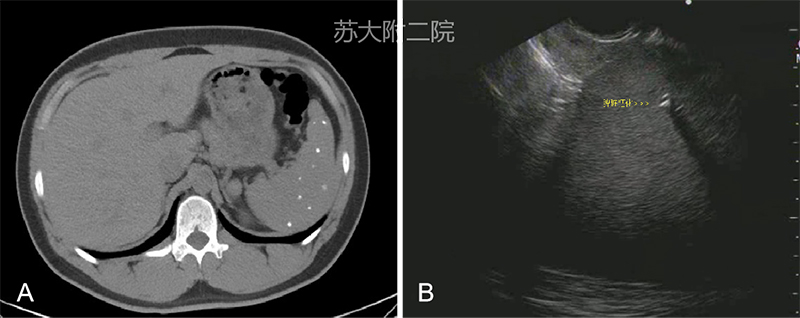
图2 脾多发钙化: A CT ;B 超声内镜
Video 3
2:脾脏淋巴管瘤
脾脏淋巴管瘤通常是由先天性局部淋巴管发育异常引起的,由于梗阻,囊下小梁和小动脉周围的淋巴管不断扩张,呈现海绵状和囊状病变。脾脏淋巴管瘤在脾脏良性肿瘤中较为常见,占总数的2/3,通常表现为单个或多个结节,有时弥漫在整个脾脏。下面患者为中年女性,CT考虑脾脏淋巴管瘤,胃镜发现胃底后壁多发隆起,EUS见脾内多个低回声囊性病灶,对胃后壁形成外压。(图3)
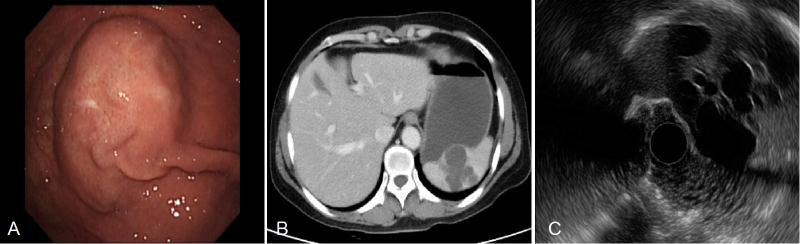
图3 脾脏淋巴管瘤: A 胃镜 ; B CT ;C 超声内镜
3: 脾脏单纯囊肿
脾脏囊肿是脾组织内单发或多发囊性改变,多无临床症状,。女性患者,胃镜检查无意中发现胃底粘膜下隆起,超声内镜提示局部胃壁五层结构清晰完整,病灶位于脾脏实质内,边界清晰,内部呈均匀无回声改变,考虑囊肿,后增强CT亦证实(图4)。
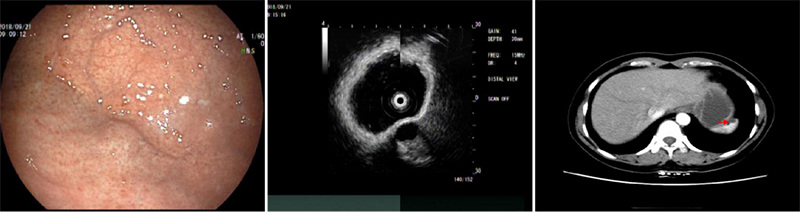
图4 脾囊肿外压 A:胃镜 ;B: 超声内镜 C: 增强CT
4:脾淋巴瘤
淋巴瘤是脾脏较常见的恶性肿瘤,它可以是全身淋巴瘤的脾脏受累,也可以是原发脾脏淋巴瘤,以前者较为多见。下面患者,49岁男性,因“腹痛9天”入院,外院腹部平扫+增强磁共振提示脾肿大、脾内多发占位、腹腔及后腹膜淋巴结肿大。EUS于胃腔探查,见腹腔干旁、脾门多发肿大淋巴结,脾脏见巨大低回声病灶,遂行EUS-FNA对肿大淋巴结和脾脏占位分别进行穿刺。(图5及video 4)。
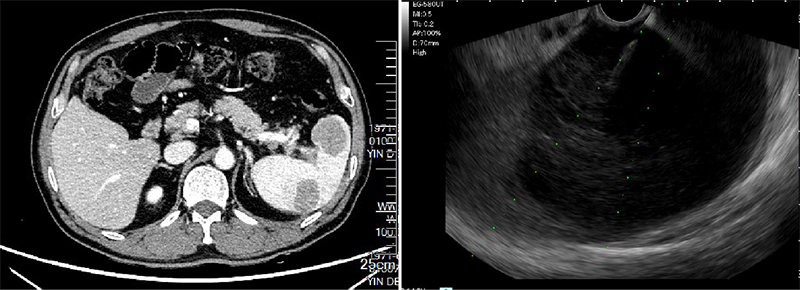
图5:脾淋巴瘤
Video 4
脾占位EUS-FNA细胞块免疫组化:LCA(+),CD20(+),CD79α(+),CD3(-),CD30(-),Ki-67(+,60%),CK-pan(-),CD5(少数散+),Bcl-2(+),Bcl-6(+),MUM1(+),CD10(少量弱+),CyclinD1(-),EBER-ISH(+),C-myc(+,约40%)(图6),高侵袭性B细胞淋巴瘤,确诊后患者至血液科接受R-CHOP方案化疗,至今情况稳定。
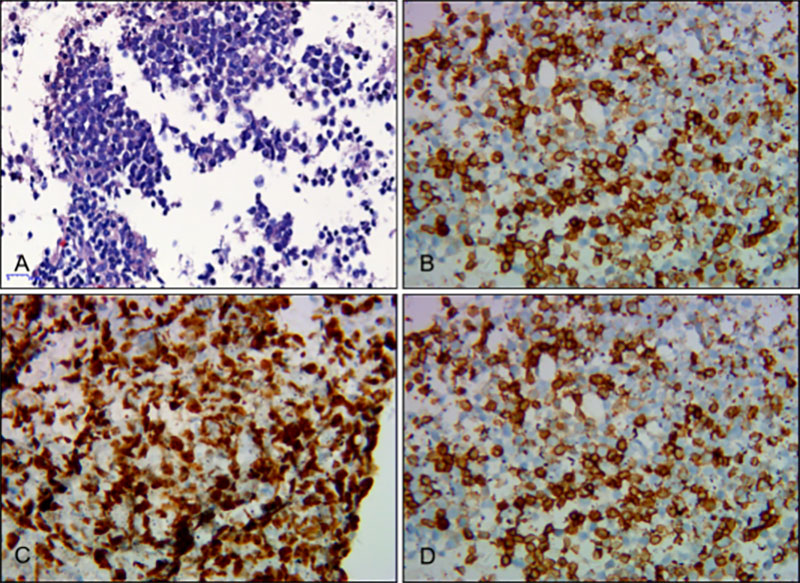
图6 脾占位EUS-FNA细胞块免疫标记
A:HE染色( 100倍)B: CD20(400倍)C:Ki67(400 倍) D: CD79a(400倍)
73岁老年男性,因“体检发现后脾脏占位一周”入院,腹部增强CT提示脾脏巨大占位,后腹膜及腹腔淋巴结增大,腹膜增厚,淋巴瘤可能,恶性肿瘤伴转移待排,腹腔积液等。EUS于胃腔探查,见肝门多发肿大淋巴结,脾内巨大低回声病灶,遂行脾脏EUS-FNA,(图7)病理组化结果诊断为弥漫大B细胞淋巴瘤。
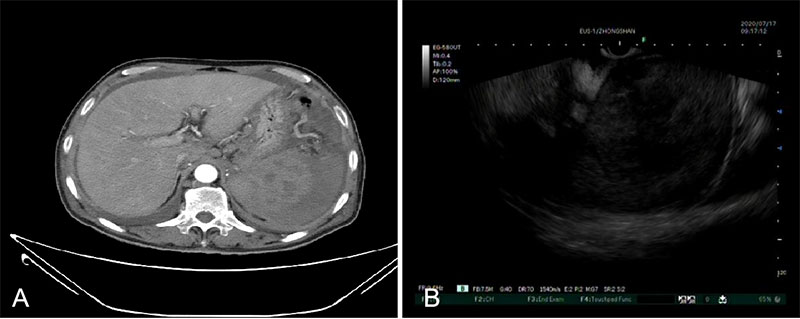
图7:脾淋巴瘤 A: CT B:EUS
脾脏在恶性淋巴瘤的分期诊断中非常重要,它有无浸润影响最终分期和治疗方案。脾淋巴瘤有四种类型:(1)脾肿大,无局灶性病变,(2)弥漫性浸润见大量的粟粒状小病变,(3)多发性离散型局灶性结节,(4)单个孤立性肿块。上述两个病例分别为第三型和第四型。
5:脾脏转移癌
脾脏的转移癌少见,其可能的原因:(1)脾脏淋巴系统发育不成熟,尤其是缺乏传入淋巴管,通过淋巴途径转移肿瘤细胞的可能性较小;(2)脾动脉走形迂曲,有时形成大的锐角,从而使大块的肿瘤细胞难以通过; (3)脾脏的微环境阻碍了微转移灶的生长。脾转移癌多继发于肺癌、乳腺癌、胃癌、胰腺癌和肝癌。转移癌的超声下特点主要是:脾脏明显增大,实质内可见多发低回声团,边缘尚清,轮廓不规则。
65岁老年男性,因左上腹疼痛不适2月于外院行B超检查提示胆囊炎并胆囊内结石,脾中部实质性占位,性质待查。入院后查CEA437.9 ng/ML,CA199>1000 U/ML。增强CT结果1.脾脏占位,考虑恶性病变,血管内皮肉瘤可能,邻近胰腺体尾部受; 2.脾包膜下异常信号灶,考虑肿瘤破裂后种植性转移; 3.大网膜和腹膜多发转移瘤; 5.区域性门脉高压:腹盆腔积液,腹腔内多发侧支循环形成。EUS于胃腔探查,见脾脏巨大低回声病灶,遂行EUS-FNA对腹腔积液、肿大淋巴结和脾脏占位进行穿刺。)病理组化结果诊断为胰腺癌。(图8 video 5 )
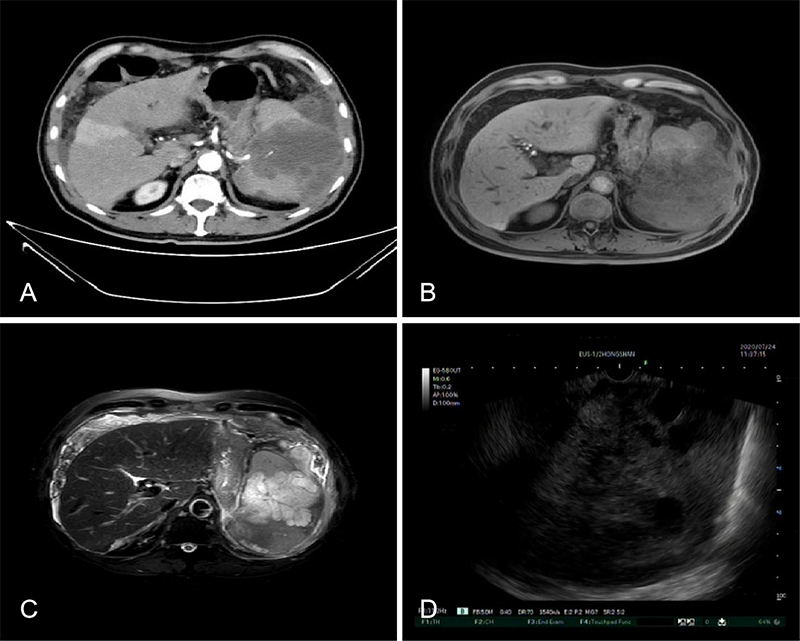
图8 脾转移癌 A: CT见脾脏内乏血供病灶 B:MRI的T1相低信号 C: MRI的T2相高信号D: EUS低回声病灶
Video 5
6:脾内淋巴细胞多克隆增生
81岁老年女性,因腹胀半月余入住我院,完善CT示:脾脏占位,两侧肺门区、纵膈及后腹膜区多发增大淋巴结,CT上脾脏占位呈不规则低密度影,增强后呈轻-中度渐进性强化。EUS见肝门及纵膈多发肿大淋巴结,脾脏低回声病灶,遂行EUS-FNA对肿大淋巴结和脾脏进行穿刺。病理结果提示淋巴细胞多克隆性增生疾病,考虑炎症性疾病。(图9 video 6 )
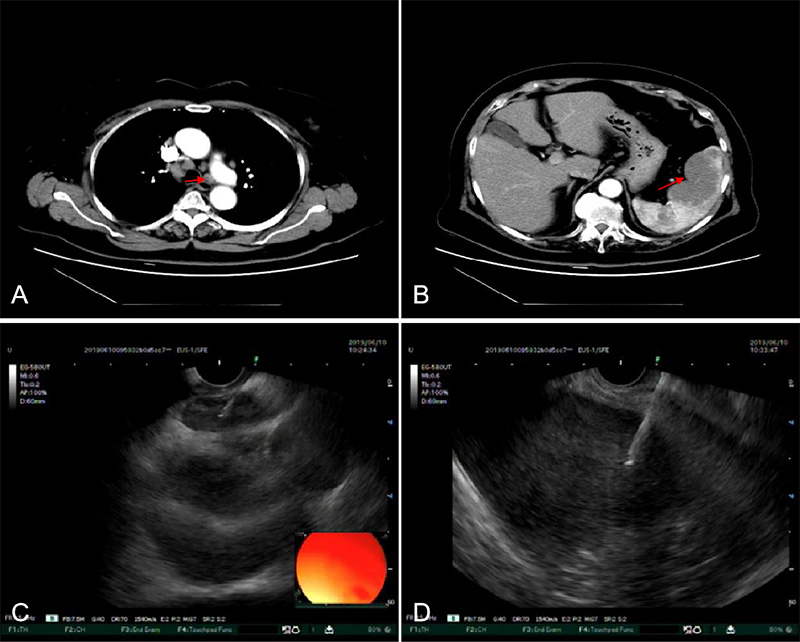
图9 脾淋巴细胞多克隆增生 A: CT纵隔肿大淋巴结 B:CT脾脏乏血供病灶 C: 纵隔淋巴结EUS-FNA D: 脾脏病灶EUS-FNA
Video 6
(三)脾门结构
EUS除能对脾脏探查外,对脾门结构的显示也是独一无二的,下面从三个方面介绍超声内镜在脾门结构中的应用。
1:副脾
副脾多是脾原基完全融合失败所导致的脾脏组织与主脾分开的先天性病灶,可以是单个或多个,通常位于脾门及脾下极附近,这是最常见的位置,其他少见部位也可位于脾胃或脾肾韧带内(下方第一个病例)、胰腺特别是胰尾部(下方第二病例)、肠壁,甚至骨盆或阴囊内,副脾多偶然发现。
病例一,60岁老年男性,因急性胰腺炎住院,CT发现靠近脾门处一结节灶,强化期变化与脾脏密度一致,EUS下该病灶与脾脏声像特征一致,诊断为副脾。(图10)
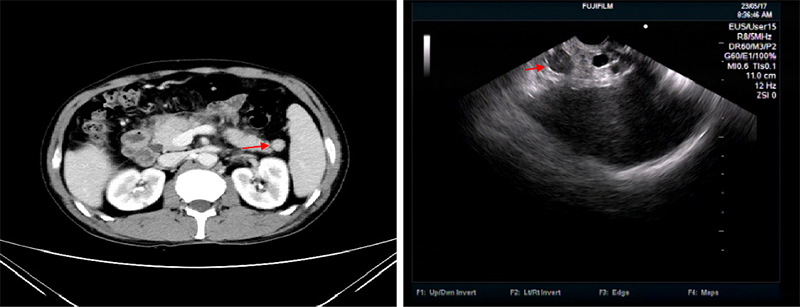
图10 副脾
病例二,50岁中年女性,无明显腹部不适症状,体检发现胰尾部肿物。腹部CT见胰腺尾部异常强化灶可疑,考虑神经内分泌瘤(G1)可能,建议进一步检查。EUS探查见胰尾混合回声类圆形病灶,回声与常见脾脏回声一致,周围无血流信号,而我们熟知的pNETs实性病变EUS表现多为边界清晰的圆形低回声病灶、血流信号多丰富、内部回声多不均匀、少数病变可为等回声或高回声,最终诊断为胰腺内种植脾。(图11、video 7)
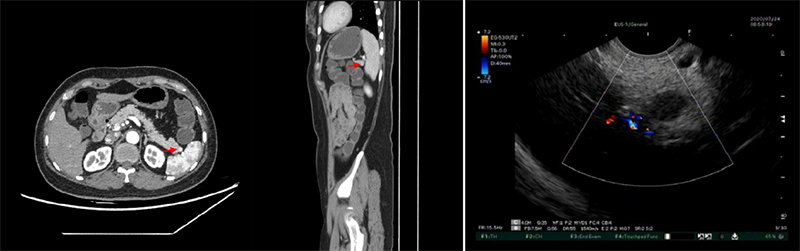
图11 胰腺内种植脾
Video7
对于外伤、血液病或自身免疫性疾病行脾切除术的患者,发现副脾的位置可位于脾门以外的地方,尤其在胰腺、胃或肠壁中时,极有可能被误诊为实体肿瘤。超声内镜下副脾表现:实性、均匀、边界清楚的结节,多呈类圆形或椭圆形,多无血流信号,而副脾具有与正常脾脏相同的回声特征,这是对其进行识别的关键。因此,熟悉正常脾脏的超声声像,再结合详细的既往病史,对于识别非典型部位的副脾至关重要,可以避免不必要的活检及手术治疗。
2:脾门淋巴结
经体表穿刺脾门淋巴结难度高、风险大,但对EUS而言却易如反掌。笔者观察到皮革胃病变主要分布在胃底体,活检阳性率底,但脾门处淋巴结转移率高,EUS-FNA穿刺往往能带来意外发现,下面患者皮革胃伴腹水,多次胃镜深挖活检阴性,EUS-FNA同时穿刺腹水和脾门淋巴结,结果脾门淋巴结确诊腺癌(图 12)。
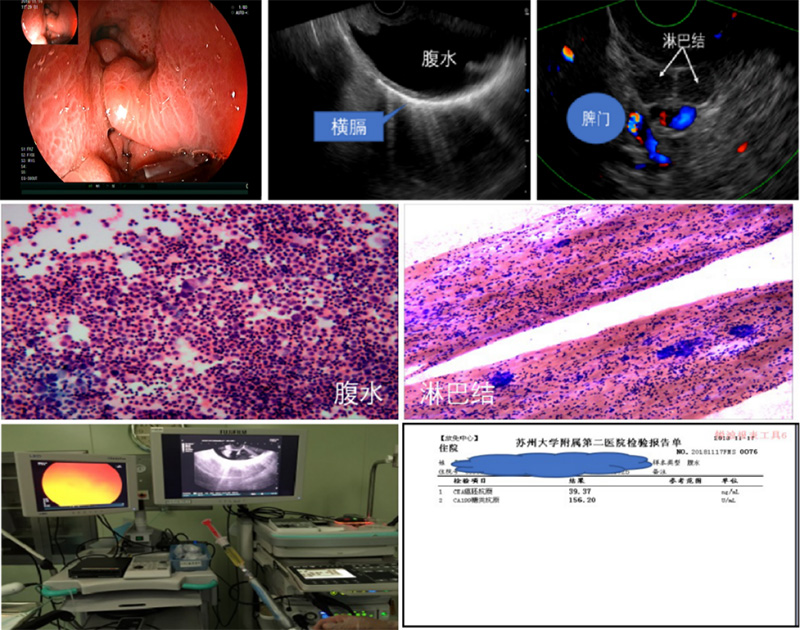
图12 皮革胃脾门淋巴结穿刺
3:脾动脉瘤
内镜下,脾门处脾动脉瘤有时与曲张静脉相似,通过频谱多普勒可以鉴别,下面病例因胃镜提示胃底黏膜下隆起就诊,行超声内镜检查,见胃底一巨大黏膜下隆起灶(图13A),EUS示胃壁结构层次完整,后方脾动脉迂曲呈结节样隆起,多普勒见隆起灶内彩色血流信号,频谱呈现动脉波形(图13 B)。进一步完善腹部增强CT血管成像,见胃底周围脂肪间隙见脾动脉走形迂曲,局部呈瘤样扩张,考虑脾动脉瘤(图13 C-D)。
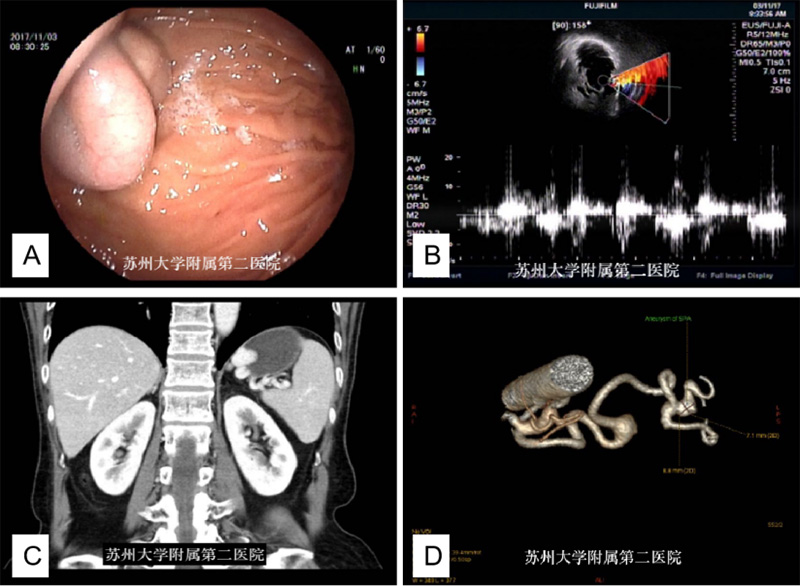
图13 A:内镜下见胃底巨大黏膜下隆起 B:EUS频谱多普勒见病灶内动脉波形C: CT冠状位见脾动脉迂曲伴扩张,压迫胃壁 D:血管重建可见脾动脉瘤样扩张
(四)脾脏的EUS-FNA
随着影像检查方法的进步,越来越多的脾脏病变被发现,而影像工具只能提供初步诊断,部分病例为进一步治疗,需要得到最终病理。尤其是当脾是唯一存在异常病变或是最容易进行被活检时,获取脾脏病变的病理显得尤为重要。既往获取脾组织的方法包括脾切除术和经皮超声引导下活检。随着超声内镜技术的发展,EUS-FNA被证实也是可行的。但在临床实践中,由于脾脏穿刺存在一定的风险,以及对超声内镜操作者的经验技术有一定的要求,目前应用并不广泛。
当患者有腹部手术史、腹腔积液、或者过度肥胖时,经皮影像学引导下脾穿刺存在一定限制,相关风险也明显提高;此外,当病灶较小,或者病变位于脾门时,经皮穿刺更为困难;EUS引导下的脾脏活检作为一种较新的获取病理方式,利用胃壁与脾脏毗邻的位置优势,同时借助彩色多普勒监测血流,很大程度上减少了出血等并发症。实际操作时,在对脾脏病灶实施EUS-FNA时,也可对纵隔、腹膜后和胃肠周围淋巴结进行采样,从而提高整体的准确率。
脾脏穿刺的主要并发症为:腹腔积血、气胸、低血压以及与穿刺相关的失血性休克。相对比较轻微的并发症有:无贫血的包膜下血肿、腹痛和血管迷走神经症状。既往研究表明,通过手术方式获取病理的并发症发生率约为8.2%;而一个大型的meta分析表明经皮穿刺总的并发症发生率为4.2%,意大利一项多中心的研究中经皮超声引导的脾脏细针活检的并发症发生率为5.2%;目前已经报道的病例研究中大部分并发症发生率为0;表明超声内镜引导下的脾穿刺基本是安全的,EUS-FNA脾活检的敏感性介于86-91%,特异性在91-97%之间。
但脾脏质地脆,穿刺它确实让人担心。就笔者有限经验,建议穿刺时注意(1)尽量选取细针,比如22G和25G的针。(2)肿瘤相对于脾脏是乏血供,故尽量少经过正常脾组织(3)尽量选用无负压或微负压穿刺。(4)大钮下压时线阵超声探头的压迫力类似于手指的机械压迫,故建议穿刺后,探头深压数分钟。总之、脾脏EUS-FNA是一种相对安全,值得信赖的临床技术,希望本期文章对大家有所帮助。
Reference:
1.John E. Skandalakis, Lee J. Skandalakis, Panagiotis N Skandalakis, et al. Spleen. Surgical Anatomy and Technique, 2010: 603-635.
2.Gary R. Schooler, Alison R. Hart, Nathan C. Hull, et al. Spleen. Pediatric Body MRI, 2020: 275-295.
3.Sammy Saab, Youssef Challita, David Holloman, et al. Case Series Review of the Safety and Efficacy of Endoscopic Ultrasound-Guided Splenic Mass Core Biopsy. Clin Endosc 2018;51:600-601.
4.Surinder S. Ranaa, Vishal Sharma, et al. Safety and utility of endoscopic ultrasound-guided fine-needle aspiration of focal splenic lesions: a retrospective analysis. Annals of Gastroenterology (2017) 30, 559-563
5.Darr U, Khan Z, Ali Khan M, Renno A, et al. Diagnosis of Splenic Lymphoma by Endoscopic Ultrasound Guided Fine Needle Aspiration: A Case Report and Review of the Literature. Case Rep Gastrointest Med. 2017;2017:3602910.
6.Daisuke Uchida, Koichiro Tsutsumi, Hironari Kato, et al. An Intrapancreatic Accessory Spleen That Was Difficult to Diagnose Due to Temporal Changes after Splenectomy. Intern Med. 2018 Mar 1;57(5):681-685
7.严心怡 胡端敏 吴 伟 程桂莲 徐丽明. 内镜超声引导下细针穿刺腹水和脾门淋巴结诊断皮革胃1例 胃肠病学杂志 2019;24(9)578-579.
徐丽明 吴伟 程桂莲 胡端敏
苏州大学附属第二医院消化科
EUS世界里,脾脏是个不起眼的“路人甲”,经常被各种专业书一带而过,究其原因(1)它属于血液系统,消化科医师不care(2)脾原发病少,很难遇到(3)脾脏质脆、易裂,不碰为妙。但事实上,脾脏紧邻胃底,超声内镜对它和周围结构的显示可谓“一览无余”、此外,从笔者经验和参考文献来看,脾脏EUS-FNA是一种安全,可靠、实用的临床手段,我们完全不必“谈虎色变”。因此,本期主题是EUS世界里的“小透明”---脾脏。
(一)脾脏EUS探查策略
1:环扫超声内镜脾探查的策略:
推送环扫EUS至食道下端,压大钮找寻胸主动脉并将其旋转至5点位(类似CT图像),随后环扫EUS跟随主动脉进入胃腔,进镜过程中依次可见腹腔干(celiac trunk CT)和肠系膜上动脉(Superior Mesenteric Artery SMA),腹腔干自主动脉发出后分为胃左动脉、脾动脉和肝总动脉,脾动脉前方即为胰体。探头压住胰体右旋并稍退镜,屏幕上见探头似乎从胰体滚向胰尾,最终在胰尾外侧探及脾脏和脾门(video 1)。
环扫脾脏探查(video 1)
2:线阵超声内镜脾探查的策略:
线阵型EUS进入胃腔后贴近前壁搏动处,此时显示为肝左叶,右旋转镜身约180°找到腹主动脉,循腹主动脉缓慢进镜,依次显示腹腔干(celiac trunk CT)及肠系膜上动脉(Superior Mesenteric Artery SMA)。自肠系膜上动脉稍进镜并右旋镜身,可显示胰体、尾部结构以及标准的脾动、静脉横切面。因为脾动脉走形迂曲(图1),故跟随脾静脉进一步右旋镜身并略退镜探查胰尾、左肾及左肾上腺。进一步退镜并右旋,就可探及脾脏及脾门结构。
线阵脾脏探查(video 2)

图 1 脾动脉和脾静脉
(二)脾脏疾病
脾脏原发病变包括弥漫性病变如炎症性、结核、淋巴瘤;局灶性病变如脾囊肿、淋巴瘤、血管瘤,脾梗死,恶性血管内皮肉瘤、转移癌等。脾脏病灶较沉默,缺乏明显症状,早期易漏诊、误诊。
1:脾脏多发钙化
是指脾脏局部钙盐沉积,为继发性改变,常见于脾梗死修复后、慢性炎症等。患者多无临床症状,体检时偶然发现。EUS影像表现为脾脏内点片状高回声,后方声影,当探头移动时点状高回声时隐时现,宛如星空闪烁(图2;Video3)。

图2 脾多发钙化: A CT ;B 超声内镜
Video 3
2:脾脏淋巴管瘤
脾脏淋巴管瘤通常是由先天性局部淋巴管发育异常引起的,由于梗阻,囊下小梁和小动脉周围的淋巴管不断扩张,呈现海绵状和囊状病变。脾脏淋巴管瘤在脾脏良性肿瘤中较为常见,占总数的2/3,通常表现为单个或多个结节,有时弥漫在整个脾脏。下面患者为中年女性,CT考虑脾脏淋巴管瘤,胃镜发现胃底后壁多发隆起,EUS见脾内多个低回声囊性病灶,对胃后壁形成外压。(图3)

图3 脾脏淋巴管瘤: A 胃镜 ; B CT ;C 超声内镜
3: 脾脏单纯囊肿
脾脏囊肿是脾组织内单发或多发囊性改变,多无临床症状,。女性患者,胃镜检查无意中发现胃底粘膜下隆起,超声内镜提示局部胃壁五层结构清晰完整,病灶位于脾脏实质内,边界清晰,内部呈均匀无回声改变,考虑囊肿,后增强CT亦证实(图4)。

图4 脾囊肿外压 A:胃镜 ;B: 超声内镜 C: 增强CT
4:脾淋巴瘤
淋巴瘤是脾脏较常见的恶性肿瘤,它可以是全身淋巴瘤的脾脏受累,也可以是原发脾脏淋巴瘤,以前者较为多见。下面患者,49岁男性,因“腹痛9天”入院,外院腹部平扫+增强磁共振提示脾肿大、脾内多发占位、腹腔及后腹膜淋巴结肿大。EUS于胃腔探查,见腹腔干旁、脾门多发肿大淋巴结,脾脏见巨大低回声病灶,遂行EUS-FNA对肿大淋巴结和脾脏占位分别进行穿刺。(图5及video 4)。

图5:脾淋巴瘤
Video 4
脾占位EUS-FNA细胞块免疫组化:LCA(+),CD20(+),CD79α(+),CD3(-),CD30(-),Ki-67(+,60%),CK-pan(-),CD5(少数散+),Bcl-2(+),Bcl-6(+),MUM1(+),CD10(少量弱+),CyclinD1(-),EBER-ISH(+),C-myc(+,约40%)(图6),高侵袭性B细胞淋巴瘤,确诊后患者至血液科接受R-CHOP方案化疗,至今情况稳定。

图6 脾占位EUS-FNA细胞块免疫标记
A:HE染色( 100倍)B: CD20(400倍)C:Ki67(400 倍) D: CD79a(400倍)
73岁老年男性,因“体检发现后脾脏占位一周”入院,腹部增强CT提示脾脏巨大占位,后腹膜及腹腔淋巴结增大,腹膜增厚,淋巴瘤可能,恶性肿瘤伴转移待排,腹腔积液等。EUS于胃腔探查,见肝门多发肿大淋巴结,脾内巨大低回声病灶,遂行脾脏EUS-FNA,(图7)病理组化结果诊断为弥漫大B细胞淋巴瘤。

图7:脾淋巴瘤 A: CT B:EUS
脾脏在恶性淋巴瘤的分期诊断中非常重要,它有无浸润影响最终分期和治疗方案。脾淋巴瘤有四种类型:(1)脾肿大,无局灶性病变,(2)弥漫性浸润见大量的粟粒状小病变,(3)多发性离散型局灶性结节,(4)单个孤立性肿块。上述两个病例分别为第三型和第四型。
5:脾脏转移癌
脾脏的转移癌少见,其可能的原因:(1)脾脏淋巴系统发育不成熟,尤其是缺乏传入淋巴管,通过淋巴途径转移肿瘤细胞的可能性较小;(2)脾动脉走形迂曲,有时形成大的锐角,从而使大块的肿瘤细胞难以通过; (3)脾脏的微环境阻碍了微转移灶的生长。脾转移癌多继发于肺癌、乳腺癌、胃癌、胰腺癌和肝癌。转移癌的超声下特点主要是:脾脏明显增大,实质内可见多发低回声团,边缘尚清,轮廓不规则。
65岁老年男性,因左上腹疼痛不适2月于外院行B超检查提示胆囊炎并胆囊内结石,脾中部实质性占位,性质待查。入院后查CEA437.9 ng/ML,CA199>1000 U/ML。增强CT结果1.脾脏占位,考虑恶性病变,血管内皮肉瘤可能,邻近胰腺体尾部受; 2.脾包膜下异常信号灶,考虑肿瘤破裂后种植性转移; 3.大网膜和腹膜多发转移瘤; 5.区域性门脉高压:腹盆腔积液,腹腔内多发侧支循环形成。EUS于胃腔探查,见脾脏巨大低回声病灶,遂行EUS-FNA对腹腔积液、肿大淋巴结和脾脏占位进行穿刺。)病理组化结果诊断为胰腺癌。(图8 video 5 )

图8 脾转移癌 A: CT见脾脏内乏血供病灶 B:MRI的T1相低信号 C: MRI的T2相高信号D: EUS低回声病灶
Video 5
6:脾内淋巴细胞多克隆增生
81岁老年女性,因腹胀半月余入住我院,完善CT示:脾脏占位,两侧肺门区、纵膈及后腹膜区多发增大淋巴结,CT上脾脏占位呈不规则低密度影,增强后呈轻-中度渐进性强化。EUS见肝门及纵膈多发肿大淋巴结,脾脏低回声病灶,遂行EUS-FNA对肿大淋巴结和脾脏进行穿刺。病理结果提示淋巴细胞多克隆性增生疾病,考虑炎症性疾病。(图9 video 6 )

图9 脾淋巴细胞多克隆增生 A: CT纵隔肿大淋巴结 B:CT脾脏乏血供病灶 C: 纵隔淋巴结EUS-FNA D: 脾脏病灶EUS-FNA
Video 6
(三)脾门结构
EUS除能对脾脏探查外,对脾门结构的显示也是独一无二的,下面从三个方面介绍超声内镜在脾门结构中的应用。
1:副脾
副脾多是脾原基完全融合失败所导致的脾脏组织与主脾分开的先天性病灶,可以是单个或多个,通常位于脾门及脾下极附近,这是最常见的位置,其他少见部位也可位于脾胃或脾肾韧带内(下方第一个病例)、胰腺特别是胰尾部(下方第二病例)、肠壁,甚至骨盆或阴囊内,副脾多偶然发现。
病例一,60岁老年男性,因急性胰腺炎住院,CT发现靠近脾门处一结节灶,强化期变化与脾脏密度一致,EUS下该病灶与脾脏声像特征一致,诊断为副脾。(图10)

图10 副脾
病例二,50岁中年女性,无明显腹部不适症状,体检发现胰尾部肿物。腹部CT见胰腺尾部异常强化灶可疑,考虑神经内分泌瘤(G1)可能,建议进一步检查。EUS探查见胰尾混合回声类圆形病灶,回声与常见脾脏回声一致,周围无血流信号,而我们熟知的pNETs实性病变EUS表现多为边界清晰的圆形低回声病灶、血流信号多丰富、内部回声多不均匀、少数病变可为等回声或高回声,最终诊断为胰腺内种植脾。(图11、video 7)

图11 胰腺内种植脾
Video7
对于外伤、血液病或自身免疫性疾病行脾切除术的患者,发现副脾的位置可位于脾门以外的地方,尤其在胰腺、胃或肠壁中时,极有可能被误诊为实体肿瘤。超声内镜下副脾表现:实性、均匀、边界清楚的结节,多呈类圆形或椭圆形,多无血流信号,而副脾具有与正常脾脏相同的回声特征,这是对其进行识别的关键。因此,熟悉正常脾脏的超声声像,再结合详细的既往病史,对于识别非典型部位的副脾至关重要,可以避免不必要的活检及手术治疗。
2:脾门淋巴结
经体表穿刺脾门淋巴结难度高、风险大,但对EUS而言却易如反掌。笔者观察到皮革胃病变主要分布在胃底体,活检阳性率底,但脾门处淋巴结转移率高,EUS-FNA穿刺往往能带来意外发现,下面患者皮革胃伴腹水,多次胃镜深挖活检阴性,EUS-FNA同时穿刺腹水和脾门淋巴结,结果脾门淋巴结确诊腺癌(图 12)。

图12 皮革胃脾门淋巴结穿刺
3:脾动脉瘤
内镜下,脾门处脾动脉瘤有时与曲张静脉相似,通过频谱多普勒可以鉴别,下面病例因胃镜提示胃底黏膜下隆起就诊,行超声内镜检查,见胃底一巨大黏膜下隆起灶(图13A),EUS示胃壁结构层次完整,后方脾动脉迂曲呈结节样隆起,多普勒见隆起灶内彩色血流信号,频谱呈现动脉波形(图13 B)。进一步完善腹部增强CT血管成像,见胃底周围脂肪间隙见脾动脉走形迂曲,局部呈瘤样扩张,考虑脾动脉瘤(图13 C-D)。

图13 A:内镜下见胃底巨大黏膜下隆起 B:EUS频谱多普勒见病灶内动脉波形C: CT冠状位见脾动脉迂曲伴扩张,压迫胃壁 D:血管重建可见脾动脉瘤样扩张
(四)脾脏的EUS-FNA
随着影像检查方法的进步,越来越多的脾脏病变被发现,而影像工具只能提供初步诊断,部分病例为进一步治疗,需要得到最终病理。尤其是当脾是唯一存在异常病变或是最容易进行被活检时,获取脾脏病变的病理显得尤为重要。既往获取脾组织的方法包括脾切除术和经皮超声引导下活检。随着超声内镜技术的发展,EUS-FNA被证实也是可行的。但在临床实践中,由于脾脏穿刺存在一定的风险,以及对超声内镜操作者的经验技术有一定的要求,目前应用并不广泛。
当患者有腹部手术史、腹腔积液、或者过度肥胖时,经皮影像学引导下脾穿刺存在一定限制,相关风险也明显提高;此外,当病灶较小,或者病变位于脾门时,经皮穿刺更为困难;EUS引导下的脾脏活检作为一种较新的获取病理方式,利用胃壁与脾脏毗邻的位置优势,同时借助彩色多普勒监测血流,很大程度上减少了出血等并发症。实际操作时,在对脾脏病灶实施EUS-FNA时,也可对纵隔、腹膜后和胃肠周围淋巴结进行采样,从而提高整体的准确率。
脾脏穿刺的主要并发症为:腹腔积血、气胸、低血压以及与穿刺相关的失血性休克。相对比较轻微的并发症有:无贫血的包膜下血肿、腹痛和血管迷走神经症状。既往研究表明,通过手术方式获取病理的并发症发生率约为8.2%;而一个大型的meta分析表明经皮穿刺总的并发症发生率为4.2%,意大利一项多中心的研究中经皮超声引导的脾脏细针活检的并发症发生率为5.2%;目前已经报道的病例研究中大部分并发症发生率为0;表明超声内镜引导下的脾穿刺基本是安全的,EUS-FNA脾活检的敏感性介于86-91%,特异性在91-97%之间。
但脾脏质地脆,穿刺它确实让人担心。就笔者有限经验,建议穿刺时注意(1)尽量选取细针,比如22G和25G的针。(2)肿瘤相对于脾脏是乏血供,故尽量少经过正常脾组织(3)尽量选用无负压或微负压穿刺。(4)大钮下压时线阵超声探头的压迫力类似于手指的机械压迫,故建议穿刺后,探头深压数分钟。总之、脾脏EUS-FNA是一种相对安全,值得信赖的临床技术,希望本期文章对大家有所帮助。
Reference:
1.John E. Skandalakis, Lee J. Skandalakis, Panagiotis N Skandalakis, et al. Spleen. Surgical Anatomy and Technique, 2010: 603-635.
2.Gary R. Schooler, Alison R. Hart, Nathan C. Hull, et al. Spleen. Pediatric Body MRI, 2020: 275-295.
3.Sammy Saab, Youssef Challita, David Holloman, et al. Case Series Review of the Safety and Efficacy of Endoscopic Ultrasound-Guided Splenic Mass Core Biopsy. Clin Endosc 2018;51:600-601.
4.Surinder S. Ranaa, Vishal Sharma, et al. Safety and utility of endoscopic ultrasound-guided fine-needle aspiration of focal splenic lesions: a retrospective analysis. Annals of Gastroenterology (2017) 30, 559-563
5.Darr U, Khan Z, Ali Khan M, Renno A, et al. Diagnosis of Splenic Lymphoma by Endoscopic Ultrasound Guided Fine Needle Aspiration: A Case Report and Review of the Literature. Case Rep Gastrointest Med. 2017;2017:3602910.
6.Daisuke Uchida, Koichiro Tsutsumi, Hironari Kato, et al. An Intrapancreatic Accessory Spleen That Was Difficult to Diagnose Due to Temporal Changes after Splenectomy. Intern Med. 2018 Mar 1;57(5):681-685
7.严心怡 胡端敏 吴 伟 程桂莲 徐丽明. 内镜超声引导下细针穿刺腹水和脾门淋巴结诊断皮革胃1例 胃肠病学杂志 2019;24(9)578-579.