视频1
病例7:老年男性,因直肠腺癌手术,两年后肠镜复查见吻合口粘膜下隆起,考虑复发。EUS内镜视野见吻合口光滑隆起,超声图像下吻合口外侧低回声囊肿(图 13 A和B),考虑术后吻合口种植性囊肿,MRI同时证实(图13 C)。
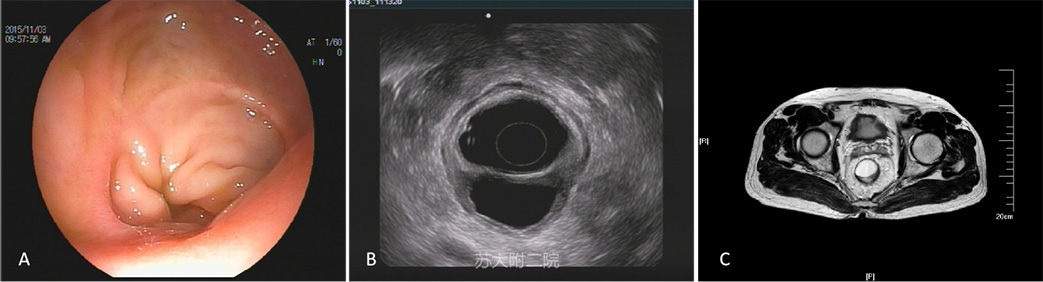
图13:吻合口种植性囊肿
EUS在直肠癌术后监测中的价值,国外研究也很少,早年的一项结果显示,相对于CT而言,EUS及引导下细针穿刺有极高的敏感性和特异性 (93%和91%)(图14)。
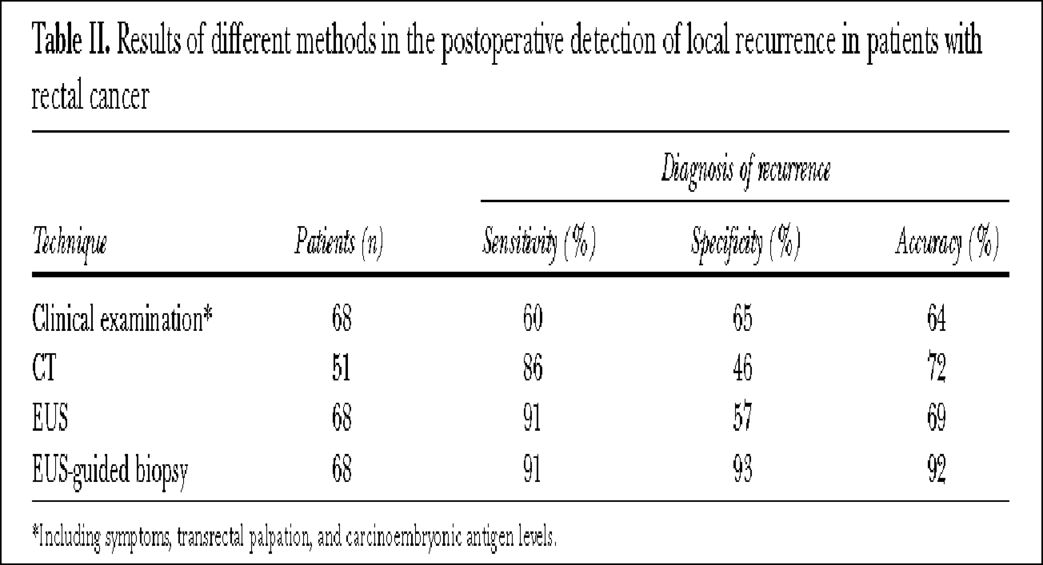
图 14 数据引用自Hünerbein M et al. The role of transrectal ultrasound-guided biopsy in the postoperative follow-up of patients with rectal cancer. Surgery. 2001 Feb;129(2):164-9.
综上,EUS能有效排除局部复发,具有高特异型。究其原因,可能是EUS检查时,先注水充分延展直肠,从而规避了肠腔塌陷、肠管堆积产生的干扰,故评估更客观、准确。下左图是小时候玩的猜中指游戏,当五个指头捏在一起时(相当于术后各段肠管堆积于盆腔),我们很难判断哪一根是中指(CT/MRI检查时),而当我们张开手掌,则十分容易(类似EUS检查时,注水延展肠壁)(图15)。
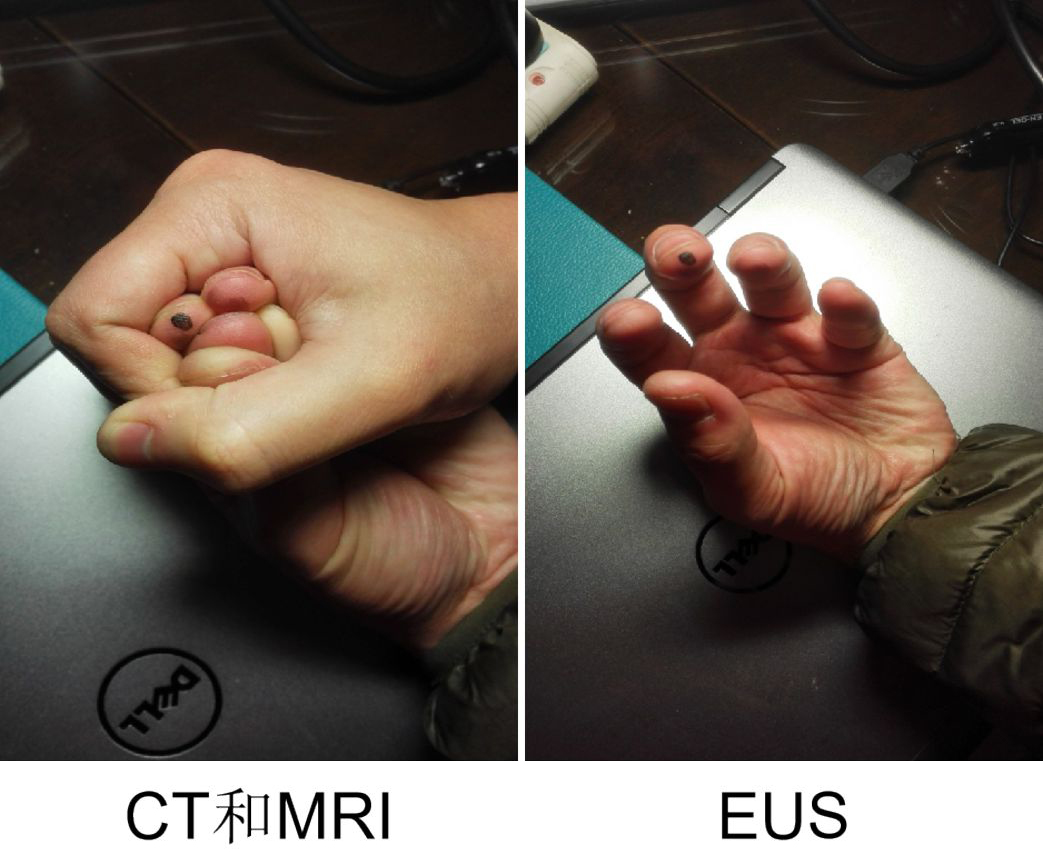
图15
(四)EUS对明确术后盆腔淋巴结转移的价值
直肠肿瘤术后,盆腔肿大淋巴结并不罕见,可以是炎症、术后放疗或转移所致。通常只能密切随访,但EUS-FNA是鉴别良、恶性淋巴结有效工具。
病例8:老年女性,外院肠镜检查示:直肠息肉样新生物。活检病理示:神经内分泌肿瘤,同时CT示肝左外叶低密度灶,考虑转移灶。行“肝左外叶切除术”和“直肠肿物切除术”。术后病理示:(肝脏)实转移性神经内分泌癌,中度分化,结合临床考虑来自直肠。(直肠)神经内分泌瘤 G2。术后化疗六次。术后密切随访,CT发现直肠周边淋巴结较前增大(图16),考虑转移。故EUS探查:吻合口未见异常,周边看见一0.7cm类圆形低回声灶,予以更换线阵EUS穿刺(图17A和B),病理提示:(盆腔淋巴结穿刺组织)见少量小圆细胞,IHC 示:LCA(-)、Syn(+)、CD56(+),考虑小圆细胞恶性肿瘤(NET)(图17 C和D)。
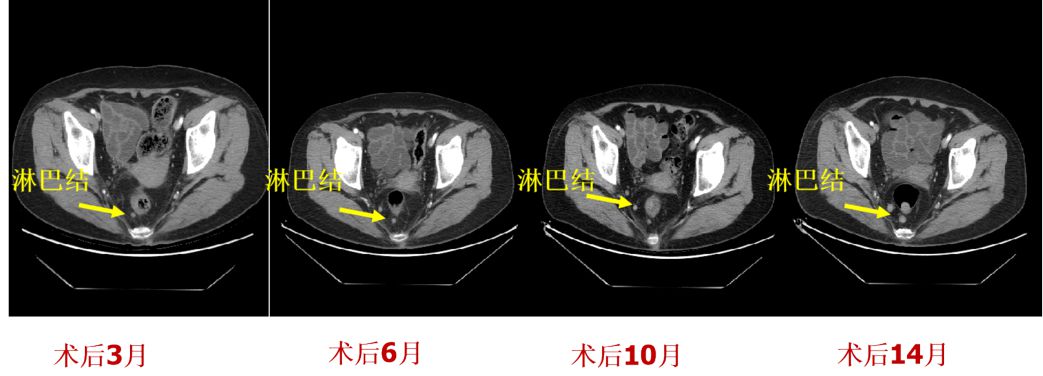
图16:CT复查随访图像
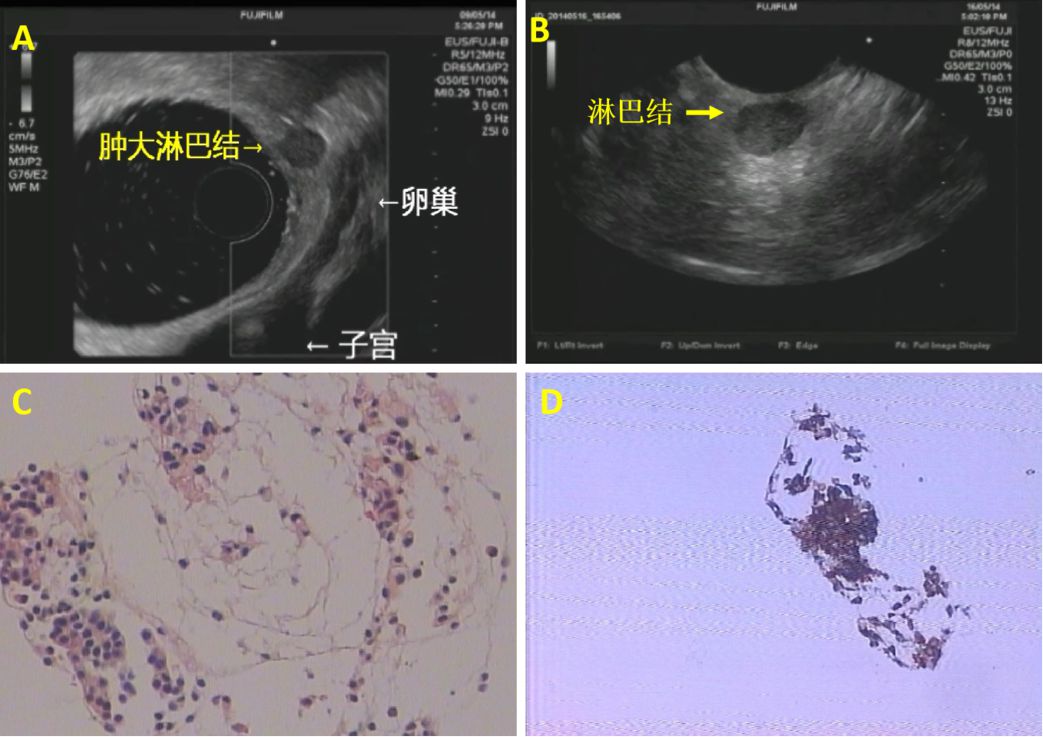
图17:EUS图像及FNA病理图
视频2
直肠癌术后监测,强调多种手段配合,依指南规范进行,EUS术者要积极参与到多学科团队中,这样不仅在临床上、学术上得到提高,也为患者真正带来益处。笔者认为EUS能够注水将肠腔充盈,能更清晰地观察到肠壁各个层次结构及周围组织情况,故对早期发现复发有较高价值,但尚需大样本的临床研究证实。本期内容是猪年的最后一次推送,预祝各位读者鼠年快乐,也期待EUS盆腔探查的最后一期---直肠周围病变和大家见面。
周春华 程桂莲 吴伟 徐丽明 吴永友 钟丰云 胡端敏
周春华(上海交通大学医学院附属瑞金医院消化科,原苏州大学附属第二医院消化科)
程桂莲 吴伟 徐丽明 胡端敏 (苏州大学附属第二医院消化科)
吴永友 钟丰云(苏州大学附属第二医院胃肠外科)
上篇小文介绍了直肠癌的EUS分期,本期主题为局部复发监测。文献报道,直肠癌术后的局部复发为5%-30%,因多数在浆膜侧,结肠镜很难早期发现。超声内镜可清晰显示直肠及周边盆腔结构,对浆膜侧的病灶敏感性高,故能早期诊断,从而获得根治性干预机会。本期内容,笔者围绕局部复发监测这一切入点,浅谈EUS的应用体会。
众所周知,直肠癌术后监测方法包括肛门指诊、血CEA、结肠镜、CT、MRI,甚至昂贵的PET-CT。既然有这么多的手段,还需要EUS吗?
图1:临床上直肠癌术后监测的常用措施
首先,我们看看最新出炉的NCCN指南:⑴ 对于经肛局部切除者: 直肠镜(同时EUS或者增强MRI),前2年内每3-6月检查1次,然后5年内每6个月检查1次。⑵ 对于I期直肠癌:外科手术后,1年复查结肠镜,如果存在高危腺瘤,1年后复查,如果没有高危腺瘤,3年后复查,再5年后复查。⑶ 对于II-IV期直肠癌,措施包括:① 病史和体检:2年内每3-6个月1次,然后5年内每6个月1次;② 2年内每3-6个月检查CEA, 然后5年内每6个月1次;③ 胸/腹盆CT: II、III期病变,5年内每6-12个月1次;IV期病变,2年内每3-6个月1次,然后5年内每6-12个月1次。④ 术后1年内行结肠镜检查,如果术前因肿瘤梗阻无法行全结肠镜检,术后3-6个月复查;如果存在高危腺瘤,1年后复查,如果没有高危腺瘤,3年后复查,再5年后复查。⑤PET-CT 不推荐作为直肠癌术后常规监测手段(图2)。

图 2:2020年NCCN指南关于直肠癌术后监测
指南中对于EUS的价值比较谨慎,缺少一些前瞻性、对照性研究。评价一项诊断方法,主要是观察它的敏感性和特异性如何,以及阳性预测值、阴性预测值,如果两者均高,说明它的准确性高。结合我们的初步实践,发现EUS在直肠肿瘤术后复发监测中具有较好的敏感性和特异性。
(一)吻合口的EUS图像
EUS除了观察吻合口粘膜面,不同于正常直肠结构,超声图像还能显示高回声吻合钉,这有助于定位吻合的浆膜侧(图3B)。此外,我们还可观察手术区域是否存在肿大淋巴结。
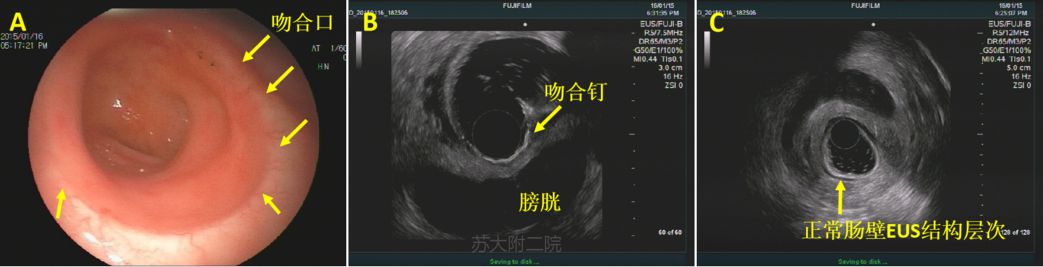
图3:直肠术吻合口处EUS图像
(二)EUS确诊直肠癌术后复发(敏感性)
随着外科手术和放、化疗方法的快速进展,直肠癌术后复发已明显减少,但及时发现仍有重要临床意义,接下来,通过几个病例介绍EUS的价值。
病例1:中年女性,因“直肠癌术后1年余,肛周不适近1月”入院。患者一年前确诊直肠癌于外院行 “直肠癌根治术(Dixon术)”,术后病理:溃疡型腺癌,分化Ⅱ-Ⅲ级,癌组织浸润肠壁全层及周围脂肪组织,神经束见癌累及(pT3N0M0- IIA 期)。术后行XELOX方案化疗六次。查体:直肠指检示吻合口左后方可及一质硬肿物,活动度尚可,无压痛,直径约1.5-2.0cm,指套无染血。血CEA正常。患者外院行结肠镜检查及CT检查均提示未见吻合口复发、转移(图4),遂来我科就诊。
EUS可见局部吻合口光滑(图5A),Radial 超声内镜提示固有肌层不均匀低回声肿块(图5B),考虑局部复发,进行穿刺(图5C),病理提示腺癌(图5D)。后患者行腹会阴联合直肠癌切除术+乙状结肠永久性造口术,术后大体病理提示 :(直肠)中分化腺癌,结合病史考虑复发,浸润深肌层,直肠、肛门切缘未见癌累及(图6)。
 图4:CT报告
图4:CT报告
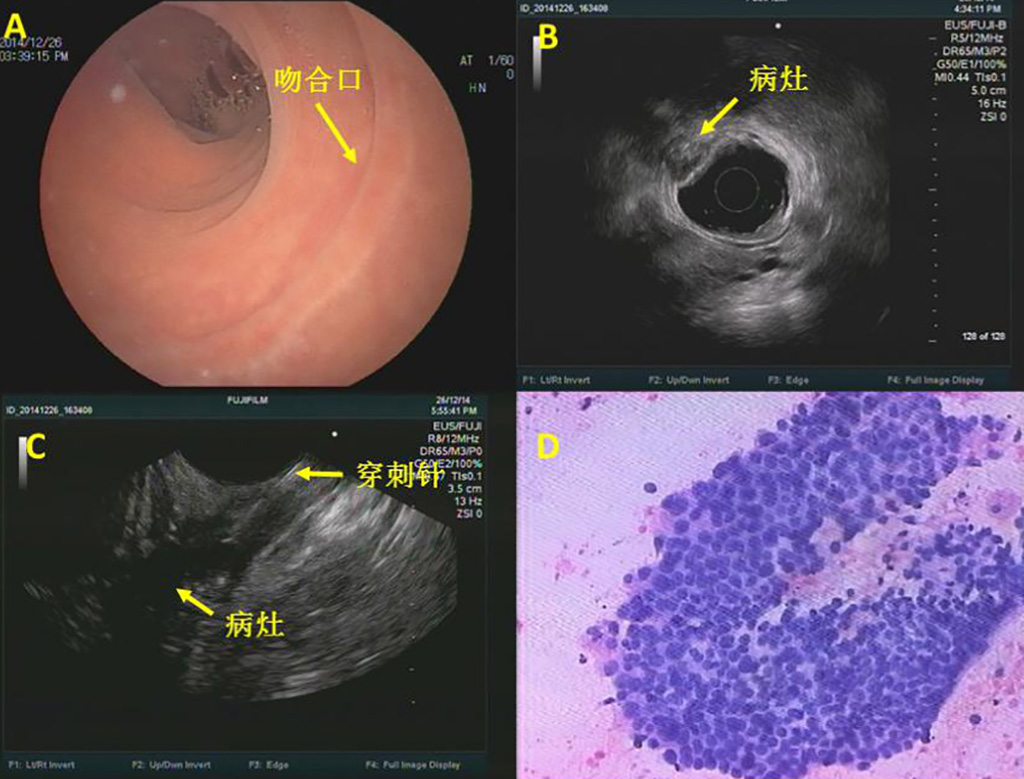
图5:EUS图像及穿刺病理
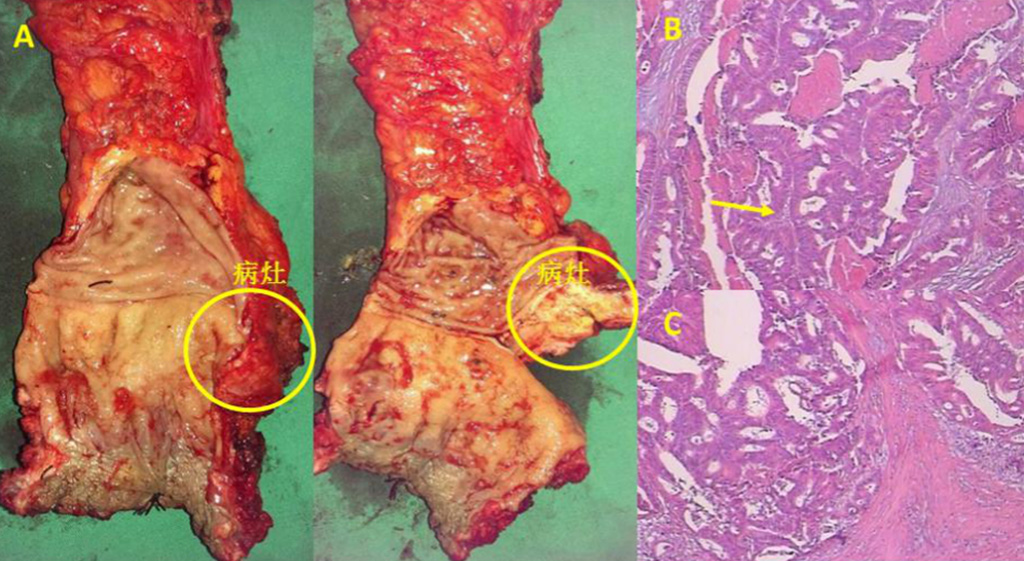
图6:大体病理及HE染色
病例2:老年男性,因直肠增生灶行经肛内镜微创手术(Transanal Endoscopic Microsurgery, TEM)治疗,术后病理提示:(直肠)腺瘤,局部高级别上皮内瘤变伴癌变,侵及粘膜下层,切缘未累及。建议追加手术,因无法保留肛门,患者拒绝,后密切随访。术后3个月第一次复查肠镜见疤痕,病理提示:急慢性炎及炎性肉芽组织增生。术后6个月第二次复查结肠镜仍见疤痕(图7A和B)。病理:慢性炎,部分上皮轻度异型增生。复查CT和MRI示直肠Ca术后改变,直肠中上段肠壁增厚。患者血CEA水平正常。EUS检查提示:直肠壁内可见不规则、不均匀低回声结节,累及固有肌层、浆膜层,凸向腔外(图7C和D)。FNA病理可见癌细胞(图7 E)。后患者再行根治术,术后病理提示:(直肠)粘液腺癌(图7 F)。
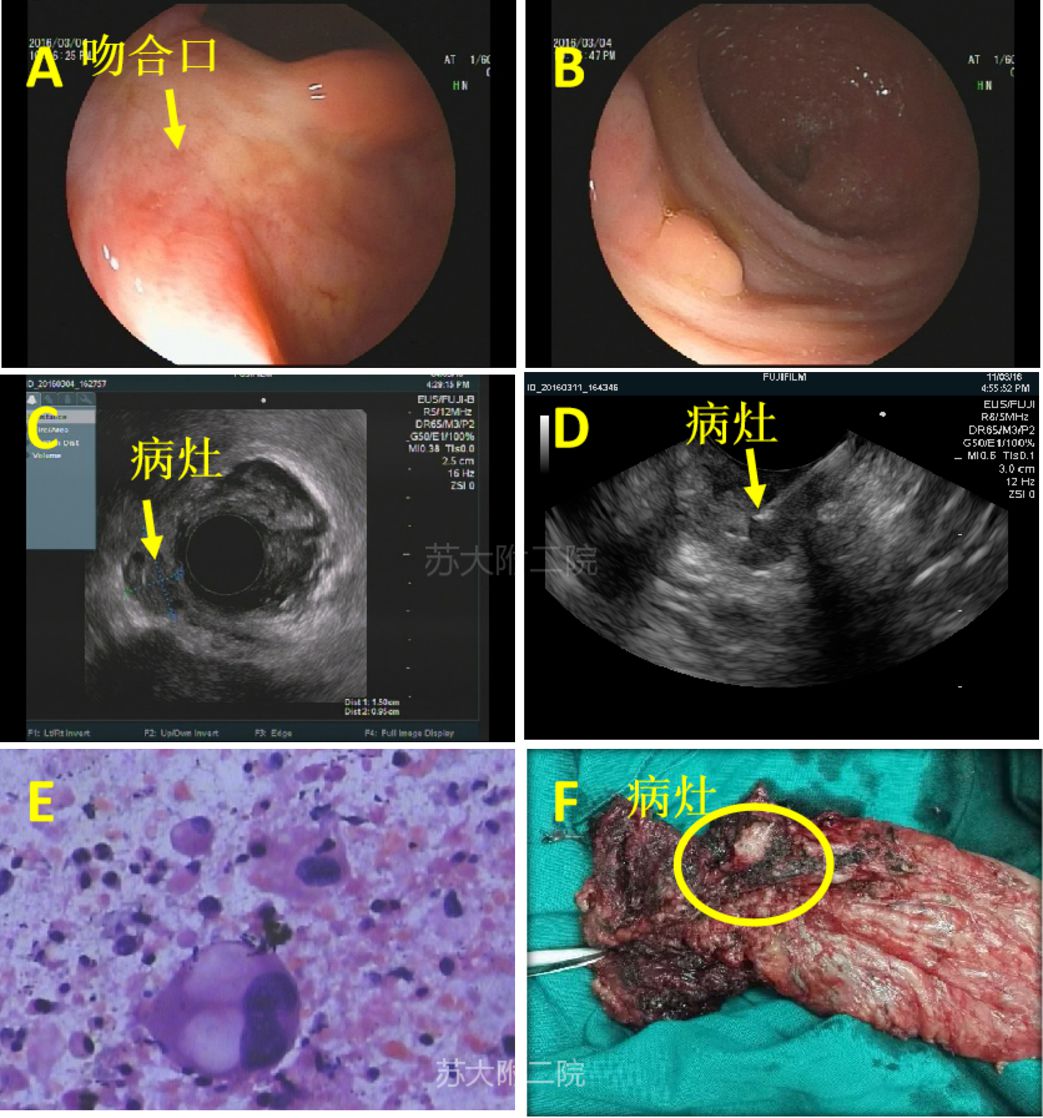
图7:结肠镜、EUS、FNA、手术标本图
病例3:老年女性,三年前因直肠肿物行经肛内镜微创手术(Transanal Endoscopic Microsurgery, TEM),术后病理,绒毛状管状腺瘤,局部癌变(中分化),侵及粘膜下层,切缘未累及。患者拒绝追加手术,术后每6-12月复查肠镜,CT,MRI。三年后复查肠镜见直肠疤痕下方隆起(图8A),EUS探查见直肠壁内不均匀低回声结节,凸向腔外(图8B和C)。FNA病理见大量粘液中散在异性细胞团,考虑肿瘤复发(图8D),同期MRI可见粘膜下方的多囊性病灶(图8E),后患者再行根治术,术后病理提示粘液腺癌(图8 F)。
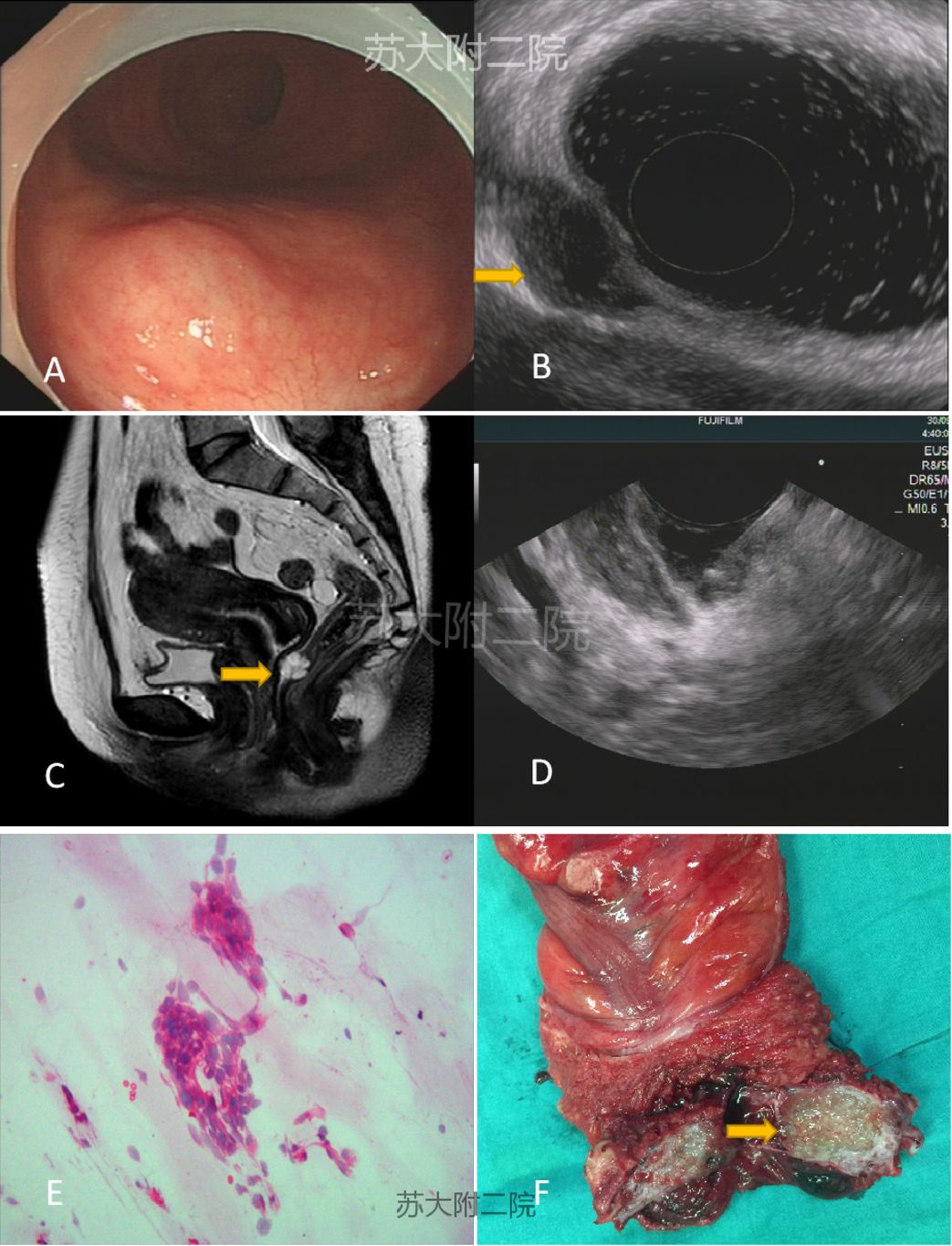
图8 A:肠镜见疤痕处隆起B:EUS见直肠壁凸向腔外结节(黄箭头)C: 盆腔MRI见直肠前壁囊性灶(黄箭头) D: EUS-FNA E: 大量粘液中散在异性细胞团 F:大体标本(黄箭头示粘液腺癌)
病例4:老年女性,2年前在外院因直肠息肉样病变行肠镜下切除手术,术后病理具体不详,来我院结肠镜检查发现直肠粘膜下隆起,表面光滑,EUS发现浆膜侧病灶,术后病理中分化腺癌,侵及全层,但粘膜面未累及,故为浆膜侧生长(图9)。
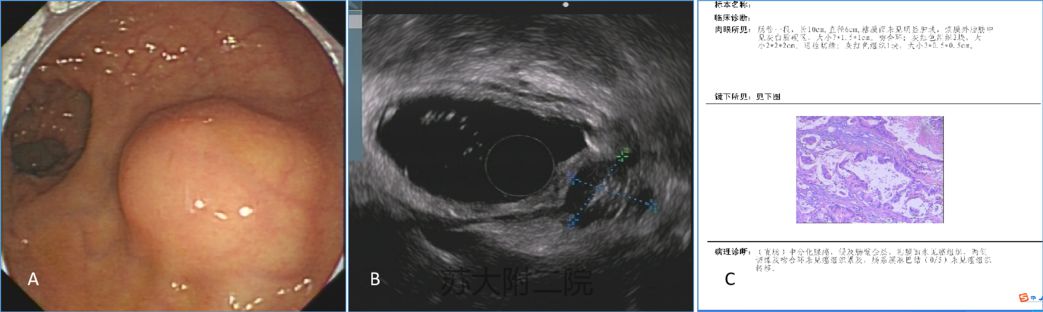
图9 A:肠镜见粘膜下隆起 B:EUS见直肠壁凸向腔外结节 C: 病理提示中分化腺癌(粘膜面未累及)
关于EUS对直肠癌术后复发的敏感性,国内也有文献报道,文中EUS确诊的两例患者,临床症状、结肠镜、CT检查均未发现异常,提示EUS具有较高的敏感性 (图10)。
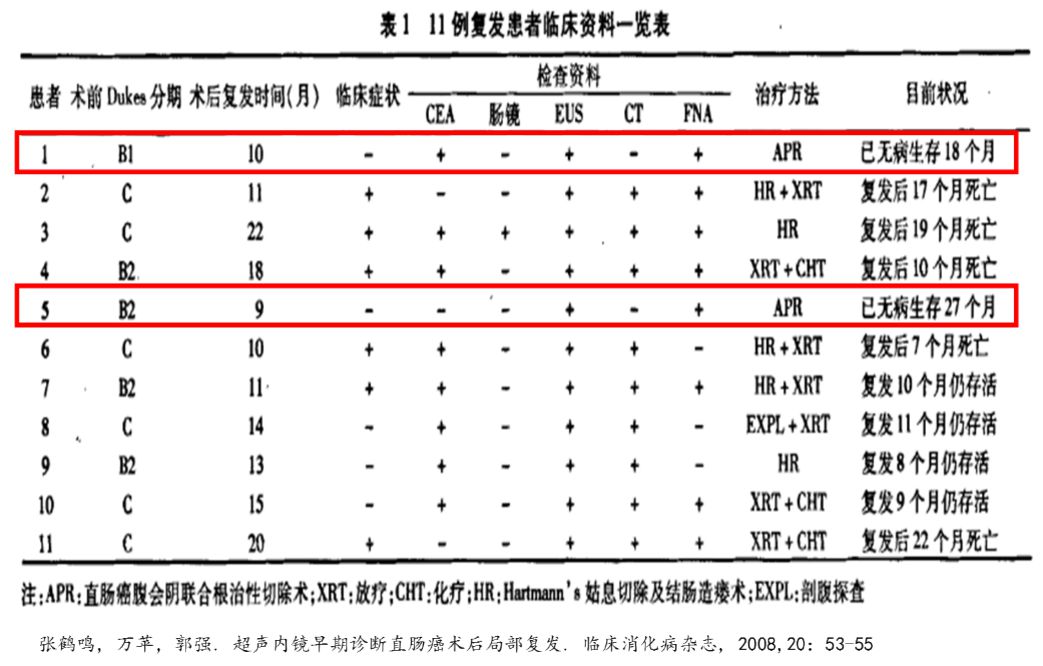
图10:超声内镜早期诊断直肠癌术后局部复发
(三)EUS排除直肠癌术后局部复发(特异性)
以上病例和文献均提示EUS有助于术后复发的早期诊断(高敏感性),现实工作中,我们发现EUS同样具有较好的特异性(排除复发),一起看看以下经典病例。
病例5:中年女性,因便血肠镜提示直肠腺癌,行Dixons手术。术后病理提示:中分化腺癌,侵及肌层,标本两切端未见癌累及,术后行3周期FOLFOX方案化疗及放化疗,半年后复查CT提示局部肠壁增厚,复发可能(图11A),EUS见吻合口光滑,肠壁层次结构清楚(图11 B和C),排除复发,随访证实。患者采用了储袋式直肠和乙状结肠吻合,致使盆腔存在较多对接肠管(图11 B),此外,放射性肠炎也导致肠壁水肿增厚,这些都增加了传统影像学对复发判断,但EUS通过注水延展肠壁,减少干扰因素,故排除复发更为自信。
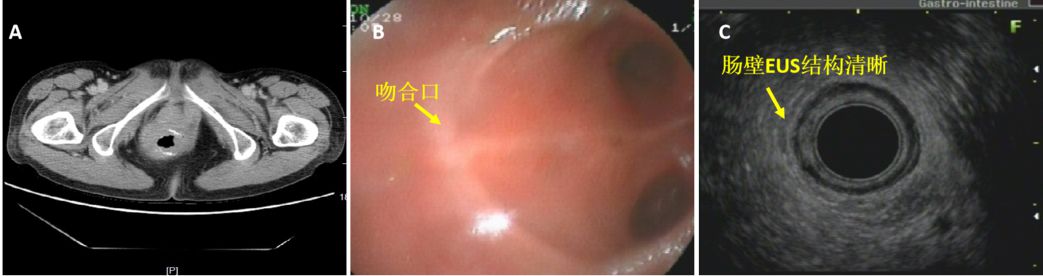
图11:CT及EUS图像
病例6:中年男性,因直肠腺癌外院手术,一年后肠镜复查见吻合口粘膜下隆起,考虑复发。EUS内镜视野见吻合口光滑隆起,旁边小开口(图12A-B),注水后粪水样物涌出(图12D和视频1),超声图像下吻合口外侧憩室,内可见混合回声(图12 C),故考虑憩室内粪石潴留,排除复发,后内镜手术证实(图12E-H)。
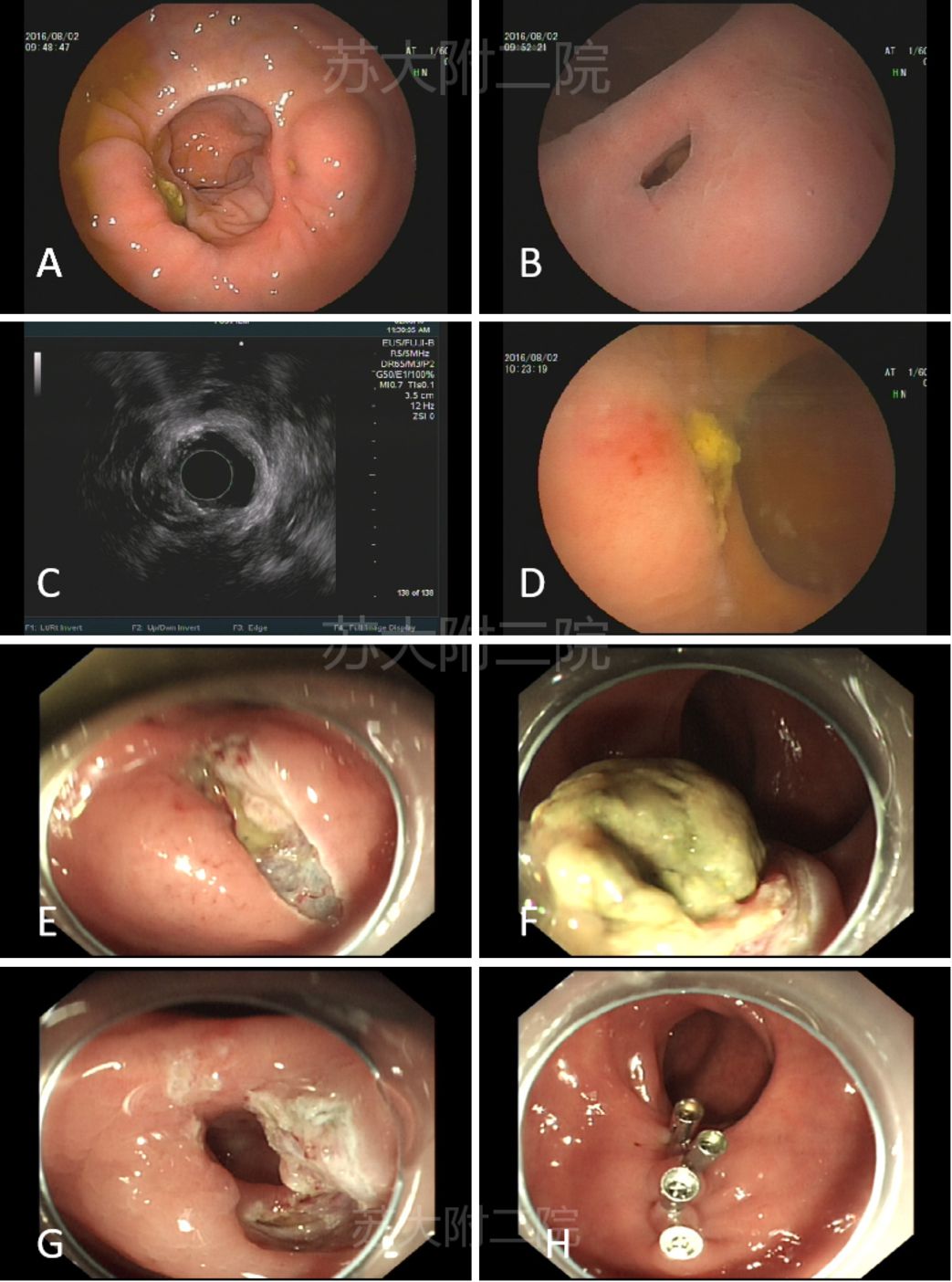
图12:吻合口憩室
视频1
病例7:老年男性,因直肠腺癌手术,两年后肠镜复查见吻合口粘膜下隆起,考虑复发。EUS内镜视野见吻合口光滑隆起,超声图像下吻合口外侧低回声囊肿(图 13 A和B),考虑术后吻合口种植性囊肿,MRI同时证实(图13 C)。

图13:吻合口种植性囊肿
EUS在直肠癌术后监测中的价值,国外研究也很少,早年的一项结果显示,相对于CT而言,EUS及引导下细针穿刺有极高的敏感性和特异性 (93%和91%)(图14)。

图 14 数据引用自Hünerbein M et al. The role of transrectal ultrasound-guided biopsy in the postoperative follow-up of patients with rectal cancer. Surgery. 2001 Feb;129(2):164-9.
综上,EUS能有效排除局部复发,具有高特异型。究其原因,可能是EUS检查时,先注水充分延展直肠,从而规避了肠腔塌陷、肠管堆积产生的干扰,故评估更客观、准确。下左图是小时候玩的猜中指游戏,当五个指头捏在一起时(相当于术后各段肠管堆积于盆腔),我们很难判断哪一根是中指(CT/MRI检查时),而当我们张开手掌,则十分容易(类似EUS检查时,注水延展肠壁)(图15)。

图15
(四)EUS对明确术后盆腔淋巴结转移的价值
直肠肿瘤术后,盆腔肿大淋巴结并不罕见,可以是炎症、术后放疗或转移所致。通常只能密切随访,但EUS-FNA是鉴别良、恶性淋巴结有效工具。
病例8:老年女性,外院肠镜检查示:直肠息肉样新生物。活检病理示:神经内分泌肿瘤,同时CT示肝左外叶低密度灶,考虑转移灶。行“肝左外叶切除术”和“直肠肿物切除术”。术后病理示:(肝脏)实转移性神经内分泌癌,中度分化,结合临床考虑来自直肠。(直肠)神经内分泌瘤 G2。术后化疗六次。术后密切随访,CT发现直肠周边淋巴结较前增大(图16),考虑转移。故EUS探查:吻合口未见异常,周边看见一0.7cm类圆形低回声灶,予以更换线阵EUS穿刺(图17A和B),病理提示:(盆腔淋巴结穿刺组织)见少量小圆细胞,IHC 示:LCA(-)、Syn(+)、CD56(+),考虑小圆细胞恶性肿瘤(NET)(图17 C和D)。

图16:CT复查随访图像

图17:EUS图像及FNA病理图
视频2
直肠癌术后监测,强调多种手段配合,依指南规范进行,EUS术者要积极参与到多学科团队中,这样不仅在临床上、学术上得到提高,也为患者真正带来益处。笔者认为EUS能够注水将肠腔充盈,能更清晰地观察到肠壁各个层次结构及周围组织情况,故对早期发现复发有较高价值,但尚需大样本的临床研究证实。本期内容是猪年的最后一次推送,预祝各位读者鼠年快乐,也期待EUS盆腔探查的最后一期---直肠周围病变和大家见面。