胆管良性占位总体分为肿瘤和非肿瘤性,上一期所述的胆管腺瘤以及报道过的脂肪瘤、纤维瘤、平滑肌瘤、错构瘤等均属于前者,非肿瘤性占位包括特发慢性增殖性炎又或组织异位症,有学者称其为“假瘤性”病变。这类疾病术前诊断困难,易被误诊。本期胆道稀客将介绍几例EUS下的“假瘤”。
病例一:
中年男性,腹痛入院,CT胆总管下端可疑占位,肝外胆管稍扩张。肝功能正常,肿瘤指标未见异常。EUS示正常十二指肠乳头,见胆总管壶腹部团块状低回声,病变凸向胆总管内侧,考虑十二指肠乳头腺瘤/癌,壶腹内型,累及胆总管下段。术后病理见壶腹部胆管壁内局灶异位胰腺组织。最终诊断胆道异位胰腺。(图1)
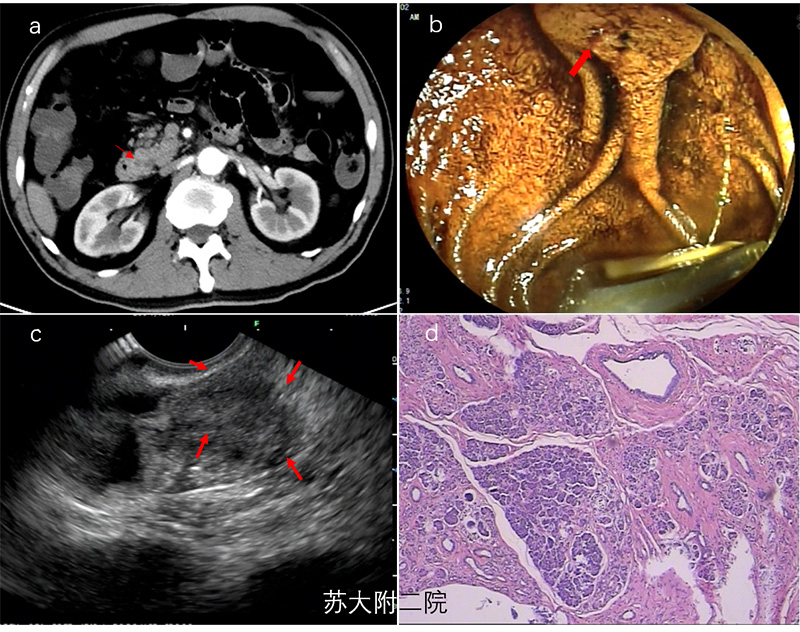
图1(a:CT声像;b:EUS白光下乳头;c: EUS下乳头内病灶;d:组织病理)
异位胰腺常见于胃和十二指肠,多位于粘膜下层,底部与固有肌层界限不清,内部回声高低混杂,典型病灶可见无回声管腔,下方肌层常反应性增厚。相对而言,胆总管异位胰腺非常罕见,生长过程中没有任何症状,可长期潜伏,文献报道的病灶也在2.0-22mm之间。胆道异位胰腺表现为程度不一的腹痛或梗阻性黄疸,这和其它胆道疾病颇为相似,各种影像检查亦无特异表现,文献报道病例均为术后诊断。合理治疗应建立在术中病理,同时结合病灶位置的基础上选择不同术式。
病例二:
老年女性患者,因右上腹痛入院。总胆14.2umol/L,直胆7.1umol/L,谷草482u/L,谷丙540 u/L ,谷氨酰转胺酶1751 u/L,碱性磷酸酶111 u/L,CA199:76.11IU/ml。CT及MRI均提示肝外胆管扩张,请结合临床。EUS:胆总管下端中低回声混合结节样回声,腺瘤可能。因既往多次腹痛和黄疸发生,最后选择手术治疗,术后病理证实胆总管下端腺肌症。(图2及视频1)。

图2(a:CT图像;b:EUS声像;c:大体手术标本;d:组织病理 )
视频1
腺肌症或者腺肌瘤,多见于胆囊,是指病灶处黏膜腺体穿入肌层或浆膜下层,并扩张呈囊状,与增生肥厚的平滑肌束混杂排列,局部形成类似于肿瘤样的肿块。它和异位胰腺一样,也是正常组织出现在异常部位,同样可呈瘤样生长,却不属于肿瘤。查阅文献,胆管腺肌症虽然极为少见,但国内外仍有零星报道,病变主要分布于胆总管中下段和壶腹部,均为术后确诊。
病例三:
老年患者,因发热伴上腹痛及肝损入院。肝功能示总胆22.87umol/L,直胆14.23umol/L,谷草41u/L,谷丙93 u/L ,谷氨酰转胺酶200u/L,碱性磷酸酶236 u/L,CA199:46.01U/ml。CT及MRI提示胆总管下段异常信号灶。EUS显示胆总管下段等回声病灶,胆管壁内膜清晰,病灶主体位于胆管壁粘膜层下,病灶固定。术后病理示胆管壁梭形细胞病变,倾向胶原纤维瘤样增生伴神经组织增生及慢性炎细胞浸润。(图3及视频2)。表现为黏膜下肿瘤的胆道占位临床罕见,本例病变由梭形细胞和炎症细胞增生导致,具体原因不明,也未查到类似报道。
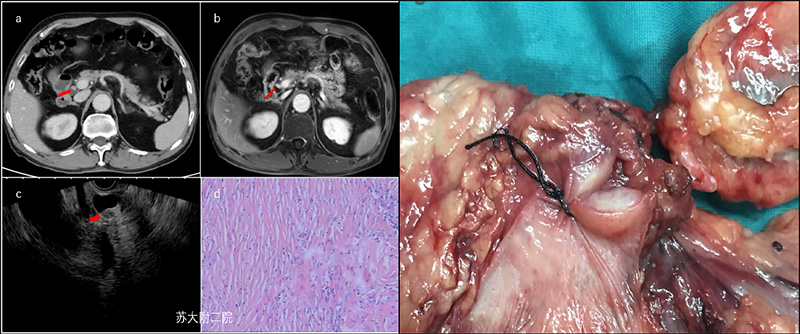
图3(a、b:CT及MRI显示胆管中段占位;c:EUS下可见胆管壁病变,病变边界清晰;d:病理可见较多胶原纤维及炎性细胞e 大体标本)
视频2
临床工作中,对于胆道疾病的筛查,尽管有高分辨CT、MRI,血肿瘤标记物等手段,但我们仍然会遇到一些的患者,临床表现不是教科书式的“三联征”、“五联症”,影像学上所发见也不能肯定地将其“定罪”或是“脱罪”,然而实验室检查却又指向胆道疾病,诊断总是让人感到云里雾里。超声内镜虽能贴近胆道细致探查,但这些病变在EUS下声像特征与胆道良/恶性肿瘤无异,均为低回声改变,内部回声不均匀,实在让人沮丧。这些病变不具有恶性肿瘤的侵袭表现,本中心遇到的几例胆管良性假瘤,边界均无蟹足样改变,但早期胆管内肿瘤亦是如此,难以鉴别。总体而言,虽单凭EUS声像无法鉴别病变性质,但EUS引导下的细针穿刺活检不失为术前病理诊断的手段之一。
超声内镜这只“王谢堂前燕“早已飞入”寻常百姓家“,时至今日,国内众多的市县级医院都引进了该设备,胆道EUS探查例数也呈指数增加,这意味着我们将遇到越来越多教课书从未描述过的病例,各种挑战无处不在。EUS术者只有和病理、影像及外科同道紧密合作,反复专研图像细节,对照大体和病理,学习当年日本学者开拓早癌研究的工匠精神,才能不断提高和前进。医学如履薄冰,如临深渊,为了减少一个个不可挽回的遗憾,行医道路中,少一些理所当然,多一些细节追究。
最后,给大家出一个思考题,中年男性,腹痛,一过性黄疸入院,肿瘤指标正常,CT和MRCP示胆总管轻度扩张(图4),请根据EUS和胆道镜视频说出可能诊断,我们会在后台回复。
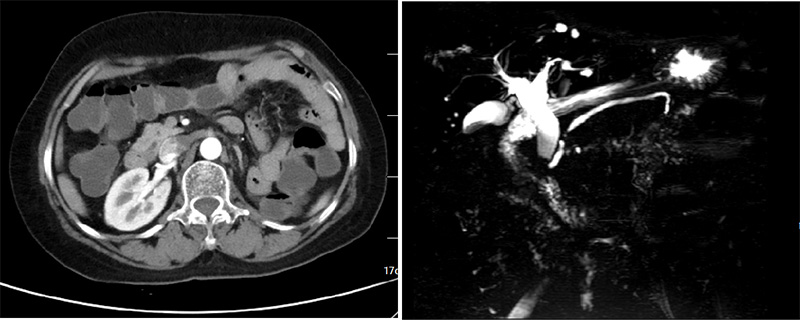
图4
视频 3
参考文献
1.Menzel J, Poremba C, Dietl KH, et al. Tumors of the papilla of Vater inadequate diagnostic impact of endoscopic forceps biopsies taken prior to and following sphincterotomy. Ann Oncol1999; 10: 1227-1231
2.Kim HJ, Park JH, Park DI, et al. Clinical usefulness of endoscopic ultrasonography in the differential diagnosis of gallbladder wall thickening. Dig Dis Sci 2012;57: 508-515
3.Navaneethan U, Njei B, Lourdusamy V, et al. Comparative effectiveness of biliary brush cytology and intraductal biopsy for detection of malignant biliary strictures: a systematic review and meta-analysis. Gastrointest Endosc 2015; 81: 168-176
4.LiY, ZhouY, GuW, etal. Obstructive jaundice caused by heterotopic pancreas. Am J Gastroenterol 2017;112(12): 1777.
5.Xu LM, Hu DM*, Tang W, Wei SH, Chen W, Chen GQ. Adenomyoma of the distal common bile duct demonstrated by endoscopic ultrasound: A case report and review of the literature. World J Clin Cases 2019; 7(21): 3615-3621
6.Armstrong CP, King PM, Dixon JM, et al. The clinical significance of heterotopic pancreas in the gastrointestinal tract. Br J Surg 1981;68(6):384–387.
7.Läuffer JM, Baer HU, Maurer CA, Fröhling S, Scheurer U, Zimmermann A, Büchler MW. Adenomyoma of the distal common bile duct mimicking cholangiocarcinoma. Dig Dis Sci 1998; 43: 1200-1204 ,
8.Colović R, Micev M, Marković J, Zogović S, Colović N, Stojković M. Adenomyoma of the common hepatic duct. HPB (Oxford) 2002; 4: 187-190.
9.Handra-Luca A, Terris B, Couvelard A, Bonte H, Flejou JF. Adenomyoma and adenomyomatous hyperplasia of the Vaterian system: clinical, pathological, and new immunohistochemical features of 13 cases. Mod Pathol 2003; 16: 530-536 .
10.Kwon TH, Park DH, Shim KY, Cho HD, Park JH, Lee SH, Chung IK, Kim HS, Park SH, Kim SJ. Ampullary adenomyoma presenting as acute recurrent pancreatitis. World J Gastroenterol 2007; 13: 2892-2894.