Join us you will be able to get the following rights
Get fresh academic and clinical information
Sign up for exclusive endoscopy contests and training courses
Use online training software
Watch the LIVE of academic conferences and surgery
经典超声内镜病例:胰周Castleman病
经典超声内镜病例:胰周Castleman病
程桂莲 吴伟 徐丽明 胡端敏
苏州大学附属第二医院 消化科
Castleman病(Castleman Disease , CD)1954年首次被报道,又称巨大淋巴结病或血管滤泡淋巴结增生症,可发生于全身各个部位,是一种罕见的淋巴增殖性疾病。据文献报道,70%的CD位于胸部淋巴结,其次是颈部(15%)、腹盆(12%)和腋窝(3%)淋巴结。CD缺乏特异性临床表现及影像学特征,易被误诊。本期和大家探讨一下CD的影像学表现,下面是我们中心最近遇到的两例胰周CD患者。
病例一
青年女性,既往体健,MRI及CT提示:胰腺后方占位,考虑1)巨淋巴细胞增生症;2)淋巴瘤待排。入院后完善相关检查,排除禁忌症后拟行EUS-FNA,EUS示胰腺钩突区异常回声,边界清晰,内部见筛孔样结构,予22G针穿刺活检,病理提示淋巴组织增生性病变,未见恶性肿瘤细胞。结合病史、影像学表现及病理,临床诊断CD,建议手术,术后病理证实CD(浆细胞亚型)(图1)
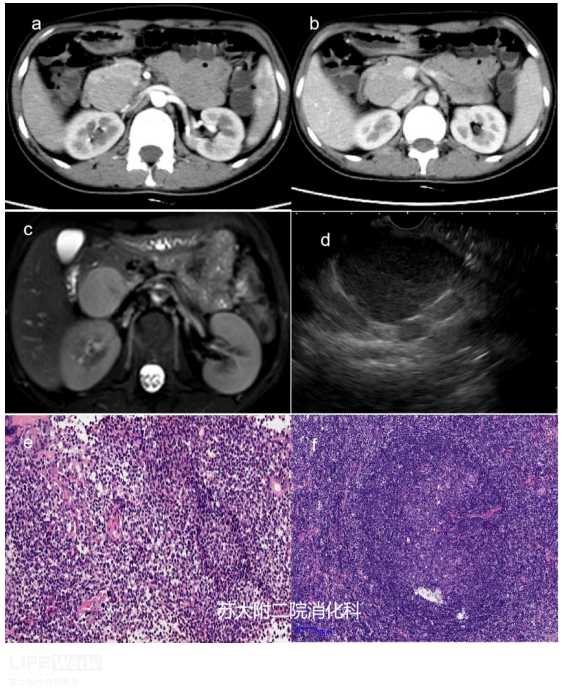
图1:a-b :动脉期及门脉期可见胰头下方见团块状软组织密度影、边界清晰、与同层胰腺呈稍等或略低程度强化模式;c:MRI下T2呈稍高信号;e、f:分别为低倍镜下FNA及手术大体病理
病例二
老年女性,2019年体检CT发现肝尾状叶占位,考虑:血管平滑肌脂肪瘤;胰头增大伴肿块样凸起,考虑胰头分叶(形态变异)可能。2021年因肺部疾病完善胸部CT,胰头病灶似乎有所增大。故而行EUS检查,肝尾状叶见团块状、边界清晰、高回声病变(视频1);胰头区域见边界清晰、组织致密、均匀低回声病灶,超声造影增强观察为富血供病灶,呈快进慢出表现(视频2),考虑非上皮神经内分泌肿瘤待排,建议完善术前检查后拟行FNA。后患者选择外科肝叶+胰头病灶切除术,术后病理证实:肝血管平滑肌脂肪瘤;腹腔胰周CD(透明血管型)。
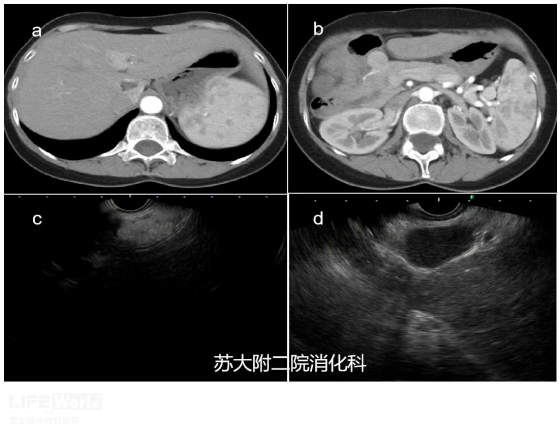
图2:a、b: CT下可见肝尾状叶病变及胰头结节状凸起;c: EUS下肝左叶见团块状高回声影;d: 胰头见边界清晰、均匀低回声病灶
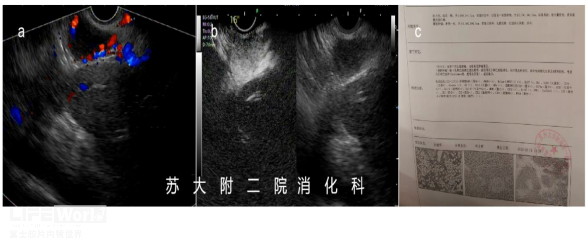
图3:a: 病灶呈富血供表现;b: 动脉期病灶呈强化模式;c: 外院手术报告
视频1
视频2
尽管本中心两例CD在病理获取上存在一定遗憾,但给我们带来了很多思考:如CD在EUS上是否具有特征性改变、EUS-FNA在CD诊断中价值如何等,带着这些疑问,我们复习了相关文献并总结如下:
由于CD临床表现不一、病理类型多样、可累及任何部位,又是一种少见疾病,因此常被误诊为相应部位的良恶性肿瘤。CD根据淋巴结受累区域可分为:单中心型CD(unicentric CD, UCD 90%)和多中心型CD(multicentric CD, MCD 10%);根据病理形态分为透明血管型 CD(hyaline vascular subtype of CD, HV-CD)、浆细胞型CD(plasma cell subtype of CD, PC-CD)及混合型CD(mixed type of CD)。MCD患者除淋巴结肿大外,往往还伴有发热、盗汗、乏力、体重下降、贫血、肝功能不全、肾功能不全、容量负荷过多(全身水肿、胸水、腹水等)等全身表现,相对易诊断。而大多数UCD 患者无伴随症状,特别是发生于胸腹腔深部区域,组织获取困难,临床诊断十分棘手。胰周CD更为罕见,容易被误诊为胰腺富血供病灶,如神经内分泌肿瘤或淋巴瘤,因不同疾病的治疗方式迥异,鉴别胰周UCD与其他富血供病变的意义重大。
EUS及其相关技术是鉴别胰腺良、恶性疾病的利器,对胰周病变,同样具有“近水楼台”的优势。熟悉胰周CD的疾病特征将有助于EUS诊断水平的提高。尽管CD缺乏特征性改变,仍有学者在不断的总结,研究者提出以下特征更支持CD(尤其是HV-CD):a、单一病变;b、圆形或准圆形,边缘清晰;c、均匀低回声,透射性好;d.内部高回声钙化;f.多普勒显示血流信号丰富;g. 明显和持续强化。然除钙化外,其他特征同样可出现在淋巴瘤、嗜铬细胞瘤等富血供病变中,下面是本中心曾遇到的相似强化模式的淋巴瘤及嗜铬细胞(视频3、4),故而定性诊断仍需病理证实。
视频3 弥漫大B淋巴瘤造影视频
视频4:嗜铬细胞瘤造影视频
CD的病理确诊依赖于充足的组织标本,病灶完整切除是最理想方式。然而,胸、腹腔深部病灶手术创伤性大,疗效不确切,因此穿刺活检是首选方式。相对于传统的经皮穿刺,EUS-FNA对于胰周病变的优势毋庸置疑。据文献报道,一共有12例胰周CD进行了术前穿刺,由于对疾病认知的有限,大部分FNA无法作出明确诊断,基本提示为淋巴组织增生性疾病,少数误诊为淋巴瘤等其他疾病,只有2例确诊为CD。第一例为Khashab MA等学者2011年在Endoscopy 发表的case,文中EUS提示胰腺上方可见一边界清晰、富血供及内部含钙化灶病变,FNA细胞学提示:在多形淋巴细胞背景下,可见部分完整的淋巴滤泡及毛细血管穿透其中,故而诊断CD,术后大体病理可见“洋葱皮”样改变,支持HV-CD(图4)。 其次,Nayak等人2022年在Pancreatology 报道第二例经EUS-FNB(endoscopic ultrasonography guided fine needle biopsy)确诊胰周CD,文献中病灶显示出花环样的血管影,FNB标本200x显微镜下可见部分血块、大量成熟淋巴细胞及“洋葱皮”样改变;400x高倍镜下可见血管穿透于滤泡中央,血管壁透明化,可见钙化灶;免疫组织化提示CD23阳性,更突显出“洋葱皮”样外观,符合HV-CD病理特征(图5)。尽管目前文献报道EUS-FNA在胰周CD的总体诊断准确性方面不理想,但从以上两个病例可见,FNB所获得的组织明显更充分。随着对该疾病认知的提升,在临床资料、传统影像辅助、相对特征性声像学改变的提示以及穿刺针内径的不断改进下,EUS及相关技术将成为胰周CD术前诊断的有价值技术。
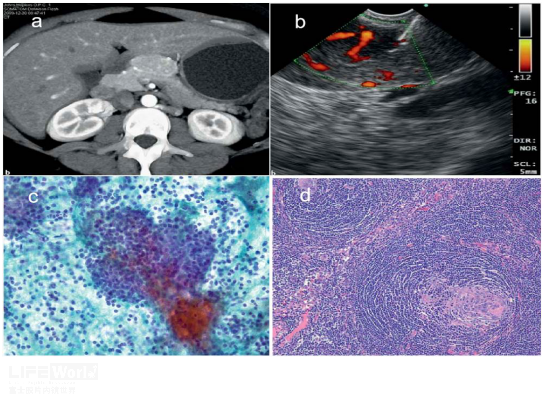
图4:a、CT下胰头上方见富血供病灶;b、EUS病灶血流信号丰富;c、在多形淋巴细胞背景下,可见部分完整的淋巴滤泡及毛细血管穿透其中;d、术后大体病理;图片来自文献Khashab MA, et al. A rare case of peripancreatic Castleman's disease diagnosed preoperatively by endoscopic ultrasound-guided fine needle aspiration. Endoscopy. 2011
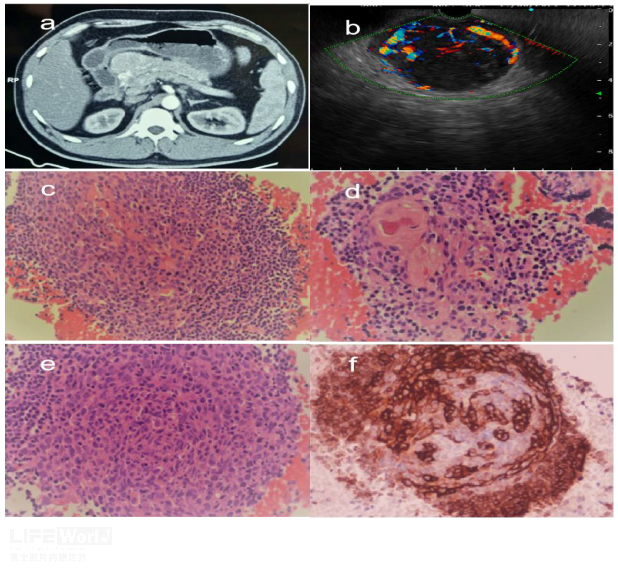
图5 a、胰头上方见富血供病灶;b、EUS下病灶呈花环样血流信号;c、200x显微镜下可见部分血块、大量成熟淋巴细胞及“洋葱皮”样改变;d、400x高倍镜下可见血管穿透于滤泡中央,血管壁透明化,可见钙化灶;e、200x“洋葱皮”样改变g、免疫组织化提示CD23阳性,更突显出“洋葱皮”样外观。图片来自Nayak HK, Pattnaik B, Patra S, et al. Pancreatic Castleman's disease: Ring of fire sign and endoscopic ultrasonography guided fine-needle biopsy helps preoperative diagnosis[J]. Pancreatology, 2022
最后,我们学习下CD的治疗及预后,UCD预后良好,手术后几乎不影响远期生存,5年生存率超过90%。MCD尤其是特发性MCD(idiopathic MCD, iMCD)预后较差。因此,治疗前应对患者进行症状、影像学检查、鉴别诊断相关检查、炎症状态及器官损伤评估四个维度的全面评估,以确定患者分型及严重程度。根据中国Castleman病诊断与治疗专家共识(2021版)指导,CD具体治疗流程见下图:
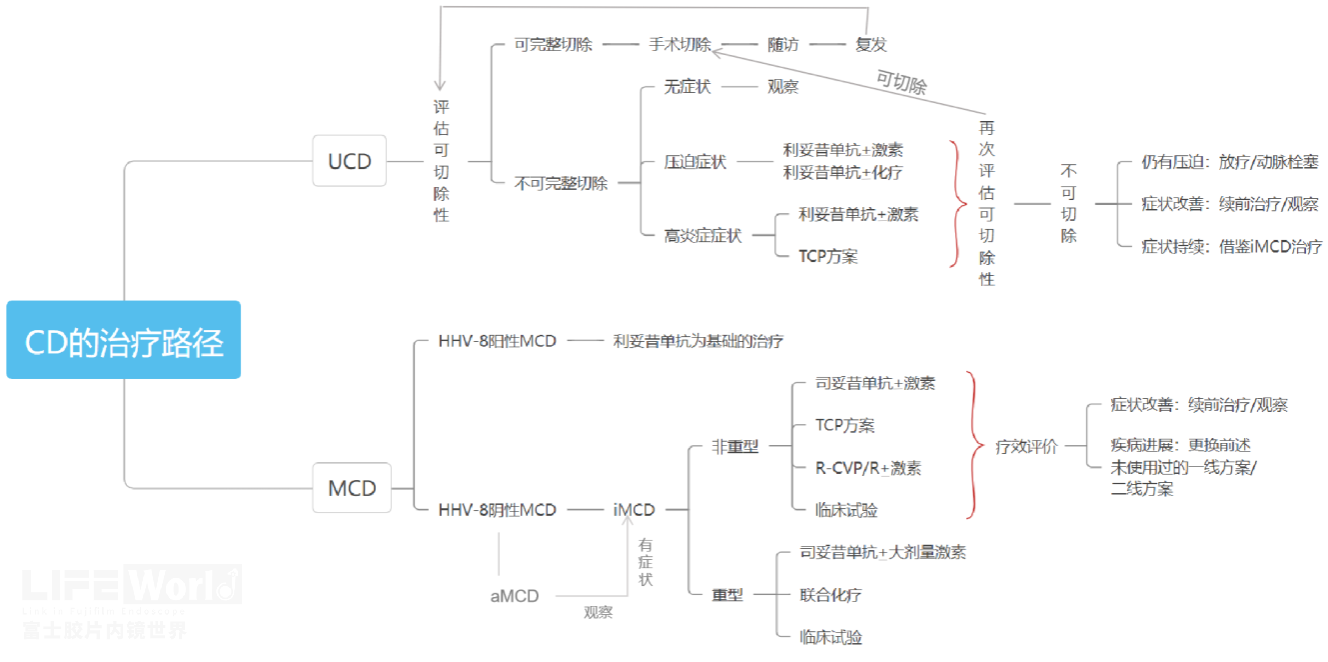
图5:CD治疗路径图(aMCD:无症状性多中心型 Castleman病; iMCD:特发性多中心型 Castleman病; HHV-8:人类疱疹病毒 8 型; TCP:沙度利安+环磷酰胺+泼尼松; R:利妥昔单抗; R-CVP:利妥昔单抗+环磷酰胺+长春新碱+泼尼松; 激素:糖皮质激素)
笔者之所以执笔这一期文章,是想让更多的EUS“超人”们认识这个疾病,进一步提高EUS的诊断水平。因CD是一种罕见的血液疾病,发病率低,在国内较罕见且认知度低,但中国人口基数庞大,其患病人群并不少。故而,EUS操作过程中一旦遇到边界清晰、回声均匀、内部散在钙化及富血供病灶,在鉴别诊断中需考虑到此病。鉴于CD的病理诊断要求,尽可能选取FNB针以便获取更多的结构性组织,同时结合临床及实验室结果进行综合性诊断,从而给予患者最精准的治疗指导。
参考文献
1. Hamel C, Avard B, Belanger C, et al. Canadian Association of Radiologists Gastrointestinal Imaging Referral Guideline[J]. Can Assoc Radiol J, 2024:8465371231217230.
2. Han Z, Han X, Li Y, et al. EUS in the diagnosis of peripancreatic Castleman disease: A case report (with video)[J]. Endosc Ultrasound, 2023,12(2):281-283.
3. Liu AY, Nabel CS, Finkelman BS, et al. Idiopathic multicentric Castleman's disease: a systematic literature review[J]. Lancet Haematol, 2016,3(4):e163-175.
4. Nayak HK, Pattnaik B, Patra S, et al. Pancreatic Castleman's disease: Ring of fire sign and endoscopic ultrasonography guided fine-needle biopsy helps preoperative diagnosis[J]. Pancreatology, 2022,22(3):443-445.
5. Zhou K, Urquhart E, Hui C. The white tree: arborising calcification indicating Castleman disease[J]. Abdom Radiol (NY), 2022,47(3):1202-1204
6. Lv K, Zhao Y, Xu W, et al. Ultrasound and radiological features of abdominal unicentric castleman's disease: A case series study[J]. Medicine (Baltimore), 2020,99(18):e20102.
7. Yin Y, Yu T, Mulmi Shrestha S. Unicentric Castleman's disease of hepatic hilum and retroperitoneum: a case report for endoscopic ultrasonography differential diagnosis and a literature review[J]. Clin J Gastroenterol, 2021,14(4):1250-1254
8. Gou H, Fan J, Luo M, et al. Castleman Disease Misdiagnosed as Pancreatic Neuroendocrine Tumor by Fine Needle Aspiration Biopsy[J]. Am Surg, 2023,89(6):2979-2981.
9. Bonekamp D, Horton KM, Hruban RH, Fishman EK. Castleman disease: the great mimic. Radiographics. 2011;31(6):1793-1807.
10. Khashab MA, Canto MI, Singh VK, et al. A rare case of peripancreatic Castleman's disease diagnosed preoperatively by endoscopic ultrasound-guided fine needle aspiration. Endoscopy. 2011;43 Suppl 2 UCTN:E128-E130. doi:10.1055/s-0030-1256163
11. Panagiotakopoulos D, Mouchtouris A, Zarakostas M, Rontogianni D, Athanasiadou P. Endosonographic features of unicentric Castleman Disease. Endosc Ultrasound. 2014;3(Suppl 1):S10-S11.
12. Pitot MA, Tahboub Amawi AD, Alexander LF, et al. Imaging of Castleman Disease. Radiographics. 2023;43(8):e220210. doi:10.1148/rg.220210
声明
富士胶片内镜世界(LIFE World)所登载的内容及其版权和使用权归作者本人与富士胶片所有。如发现会员擅自复制、更改、公开发表或其他以盈利为目的的使用,富士胶片将追究其法律责任。网站信息中涉及的治疗手技皆为术者个人针对该名患者特定体质及健康状况所采取的手法;术者对器械和药品种类的选择,也受到手术发生时间、地点等诸多因素的影响。因而相关内容及信息仅供会员参考。如盲目使用网站信息中涉及的治疗手技而发生意外,恕富士胶片及本网站对此不承担任何责任。

推荐内容
-
胰2022/03/22经典超声内镜病例:Wirsungocele-腹侧胰管末端囊肿主胰管(main pancreatic duct MPD)在胚胎第8周由背侧胰管(Santorini)和腹侧胰管(Wirsung)融合而成。融合后,Santorini管近侧段多数在胎儿期自发闭锁、消失。亦有约44%的个体,近侧段Santorini管持续开放,形成了副胰管,但管径较小(通常比Wirsung管管径小1毫米)。MPD管径自胰尾到胰头逐渐增粗,边缘光滑,2-3mm左右,其走行在MRCP可表现为为四型:下降型、S型、垂直型及环型(图1)。
-
胰2021/12/06经典超声内镜病例:假肿瘤性胰腺炎作为临床医生,看到以下两张CT图(图1),我想大多数人脑海里快速浮现的诊断便是胰腺癌。然而,有一种慢性胰腺炎,其临床表现及影像学下特征与胰腺癌极其相似,故而被称为假肿瘤性胰腺炎(Pseudotumoral Chronic Pancreatitis PCP)。PCP占慢性胰腺炎的10%~36%,病灶多位于胰头部,亦可称之为节段性慢性胰腺炎,局灶性胰腺炎、炎性肿块、肿块型胰腺炎。国外以慢性酒精中毒为主要原因;国内以胆源性为主,其他原因还包括高血脂、遗传性和自身免疫异常。临床极易与胰腺癌相混淆,但两者的治疗和预后截然不同,如何将其准确辨认成为临床重点和难点。既往文献报道,传统影像学可通过胰腺实质声像、胆胰管变化方式以及其嗜血管和神经特性等多方面特征进行鉴别(图2)。
-
胰2021/09/15经典超声内镜病例:自身免疫性胰腺炎自身免疫性胰腺炎(autoimmune pancreatitis AIP)是由自身免疫介导,以胰腺肿大(弥漫性或局灶性)和胰管不规则狭窄为特征的一种特殊类型的慢性胰腺炎。AIP有两种不同的亚型:1型和2型。1型AIP也被称为淋巴浆细胞硬化性胰腺炎(LPSP),是全身疾病过程的胰腺表现,称为免疫球蛋白G4(IgG4)相关疾病(IgG4-RD);2型AIP也称为特发性导管中心性胰腺炎(IDCP)。其中1型AIP更为常见,好发于亚洲老年男性,多伴有IgG4水平升高,对激素治疗反应好。II型好发于欧美国家,对激素治疗有争议。本文主要介绍I型AIP。两者的详细鉴别见表1。
-
胰2021/05/10经典超声内镜病例:胰腺脂肪性病变随着多模态成像技术的广泛应用,胰腺病灶的发现率逐年增高,既往的少见病变也报道的越来越频繁。胰腺肿瘤中,85%为上皮源性肿瘤(腺癌等),除此,还有1-2%的来源于间叶组织,这些间叶来源病变成份多样、良恶兼有(图1)。日益增多的胰腺“少见病”无疑对EUS术者提出更高的要求,本期分享给大家的是并不少见的“少见病”-----胰腺脂肪性病变
-
胰2020/12/16经典超声内镜病例:EUS引导下胰腺细针纹身术社会多元化的今天,纹身并不罕见,一些前卫青年甚至将其纹于臀部、乳房等私密处,但很少有人听说纹身在胰腺上吧,这并不是“危言耸听”,最新一期《Endoscopic Ultrasound》上专门介绍如何做好胰腺纹身(EUS-guilding pancreatic tattooing),这究竟是什么样的一项技术,有哪些适应症,今天我们就来聊一聊它。
-
胰2019/05/17经典超声内镜病例:胰腺癌胰腺癌是临床胰腺实性占位中最常见的疾病,2017年美国癌症协会发布的数据显示,美国胰腺癌新发病例数男性列第11位、女性列第8位,居恶性肿瘤死亡率第4位。在我国2015年统计的恶性肿瘤发病率和死亡率中排名第9和第6,病理类型可分为导管腺癌(包括腺鳞癌、胶样癌、肝样腺癌、髓样癌、印戒细胞癌、未分化癌、伴有破骨样巨细胞的未分化癌等特殊亚型)和腺泡细胞癌。