Join us you will be able to get the following rights
Get fresh academic and clinical information
Sign up for exclusive endoscopy contests and training courses
Use online training software
Watch the LIVE of academic conferences and surgery
经典超声内镜病例:胰腺癌
经典超声内镜病例:胰腺癌
作者 | 吴伟 徐丽明 程桂莲 胡端敏
来源 | 苏州大学附属第二医院消 化科
编者按:就胰腺癌诊断而言,超声内镜远不只是EUS- FNA
胰腺癌是临床胰腺实性占位中最常见的疾病,2017年美国癌症协会发布的数据显示,美国胰腺癌新发病例数男性列第11位、女性列第8位,居恶性肿瘤死亡率第4位。在我国2015年统计的恶性肿瘤发病率和死亡率中排名第9和第6,病理类型可分为导管腺癌(包括腺鳞癌、胶样癌、肝样腺癌、髓样癌、印戒细 胞癌、未分化癌、伴有破骨样巨细胞的未分化癌等特殊亚型)和腺泡细胞癌。
胰腺癌平扫CT多表现为等密度,仅局限性胰腺轮廓改变或没有改变,故平扫CT检查易漏诊,尤其早期胰腺癌,但有时可发现间接征象特别是进展期肿瘤,如肿瘤远端胰腺萎缩、胰管不同程度的扩张、或伴有假性潴留性囊肿形成。
CT增强扫查时表现为乏血供,动脉晚期表现为均匀或不均匀的低密度病灶,病灶较大时边缘呈规则或不规则的环状强化,静脉期或延迟期仍为低密度,但与正常胰腺的对比不如动脉期明显,病灶多容易侵犯周边血管,此时可发现病灶与血管之间的脂肪间隙消失,血管被包绕、狭窄、移位或闭塞,常累及肠系膜上动脉、肠系膜上静脉、腹腔干、脾静脉、门静脉。
肿块在MRI的T1WI呈稍低信号,T2WI呈稍高信号,早期病灶类似神经内分泌肿瘤,呈类圆形;较大的病灶中央可发生坏死,此时中央T2WI呈高信号,表现为囊实性占位。增强扫查后,早期肿瘤的强化低于胰腺实质,呈低信号, 5-10分钟后呈等信号或稍高信号。肿瘤侵犯周边血管及组织时其表现类似与CT。EUS显示胰腺实质内边缘不规则、呈蟹足样生长的不均质的低回声肿块,有时内部可见囊性坏死,高回声表现少见,部分病灶胰腺实质萎缩,胰管囊性扩张,累及周边组织及血管可出现类似CT、MRI的间接征象。
因此典型的胰腺癌通过上述三种影像学均容易确诊,下面分享几例典型胰腺癌病例。
病例一
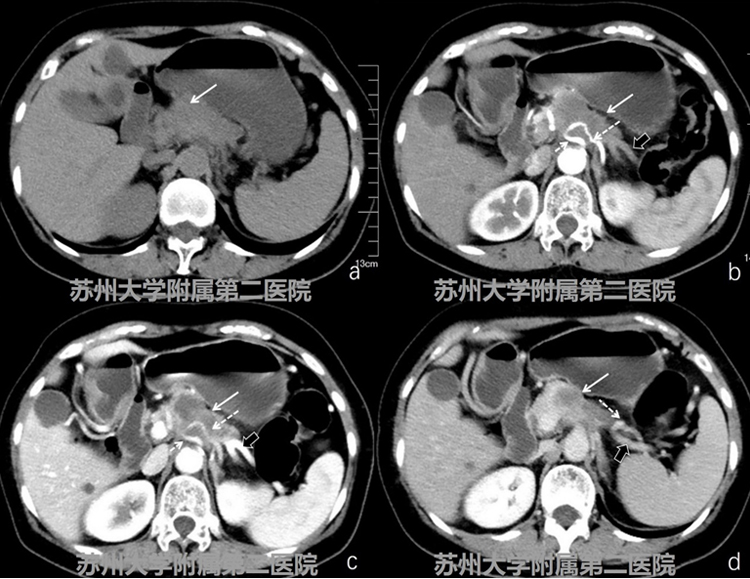
图1-1CT平扫+增强
患者,女性,考虑胰 腺癌。CT平扫胰腺体部可见低密度软组织影,增强扫查病灶轻度欠均匀强化,强化程 度低于周边正常胰腺组织,腹腔干、脾动脉及脾静脉受累(图1-1病灶:白色实箭头; 腹腔干:细短白色虚箭头;脾动脉:细长白色虚箭头;脾静脉:短粗黑实箭头)。
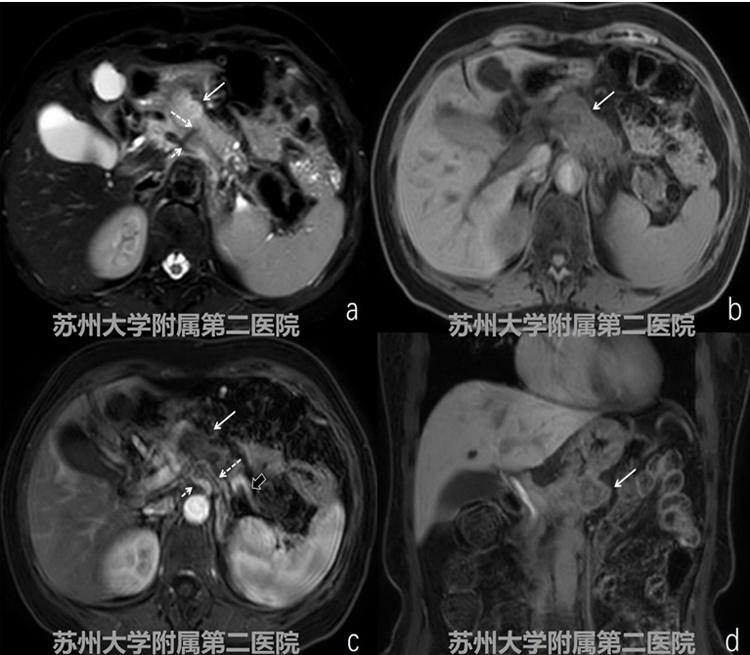
图1-2 MRI平扫+增强
MRI提示胰腺体部 见不规则团块,团块T2W-SPAIR呈稍高信号、T1WID呈等低信号,增强扫查可见病灶 呈轻度渐进性强化,病灶累及腹腔干及其分支(图1-2病灶:白色实箭头;腹腔干:细 短白色虚箭头;脾动脉:细长白色虚箭头;脾静脉:短粗黑实箭头)。
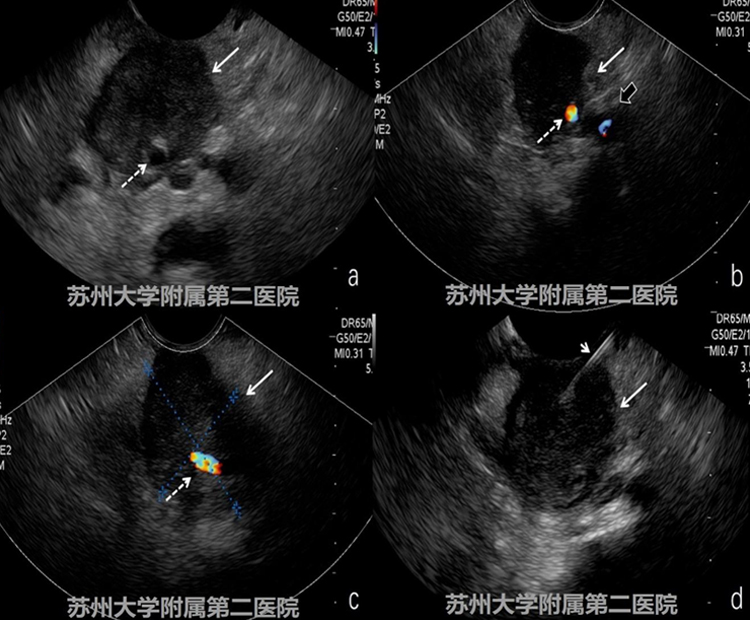
图1-3 EUS
EUS提示胰体低回声病灶,病灶周边呈锯齿样浸润性生长,病灶累及脾动脉、脾静脉,穿刺病理提示胰腺导管细胞癌(图1-3病灶:白色实箭头;脾动脉:细长白色虚箭头;脾静脉 :短粗黑实箭头)。
病例二
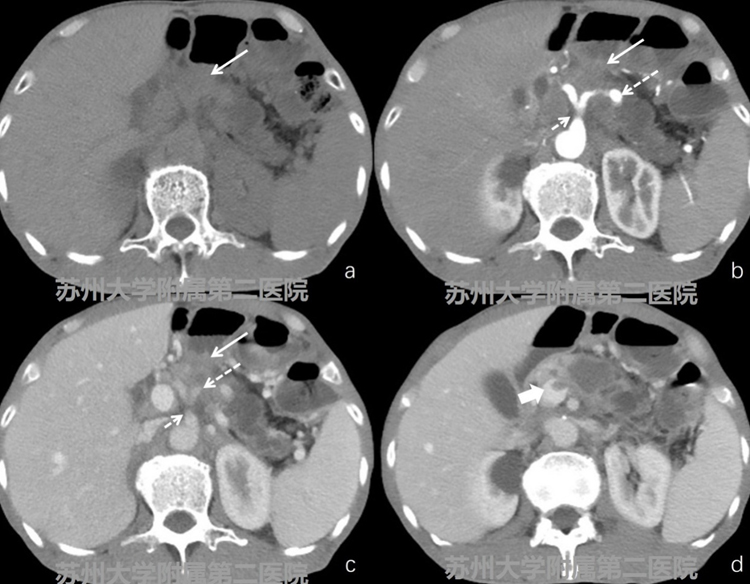
图2-1CT平扫+增强
患者,男性,62岁,胃大部切除术后,考虑胰腺癌。CT平扫胰腺体部可见低密度软组织影,增强扫查病灶轻度强化,强化程度低于周边正常胰腺组织,病灶内可见腹腔干及脾动脉通过,同时脾静脉受累,门静脉局部可见癌栓(图2-1病灶:白色实箭头;腹腔干:细短白色虚箭头;脾动脉:细长白色虚箭头;癌栓:粗短白实箭头)。
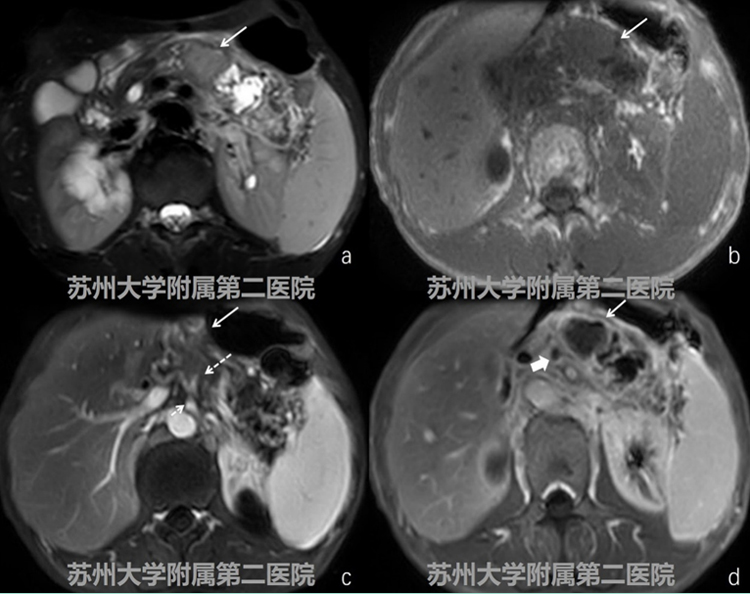
图2-2MRI平扫+增强
MRI提示胰腺体部见 不规则团块,团块T2W-SPAIR呈稍高信号、T1WI呈等低信号,增强扫查可见病灶呈不 均匀性强化,强化程度低于正常胰腺组织,病灶累及腹腔干及其分支、脾静脉,门静脉可见癌栓(图2-2病灶:白色实箭头;腹腔干:细短白色虚箭头;脾动脉:细长白色 虚箭头;癌栓:粗短白实箭头)。
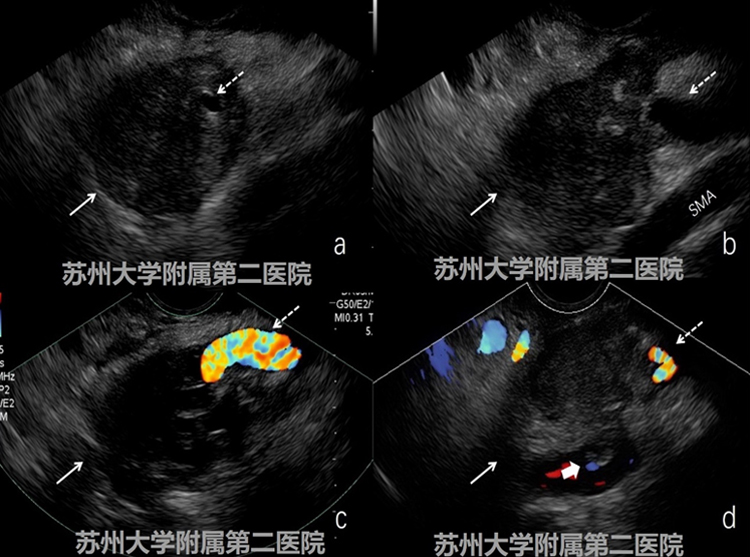
图2-3EUS
EUS提示胰体低回声病灶,病灶周边呈锯齿样浸润性生长,病灶累及腹腔干、脾动脉、脾静脉,门静脉可见栓子;穿刺病理提示胰腺导管细胞癌。(图2-3病灶:白色实箭头;腹腔干:细短白色虚箭头;脾动脉:细长白色虚箭头;癌栓:粗短白实箭头)。
病例三
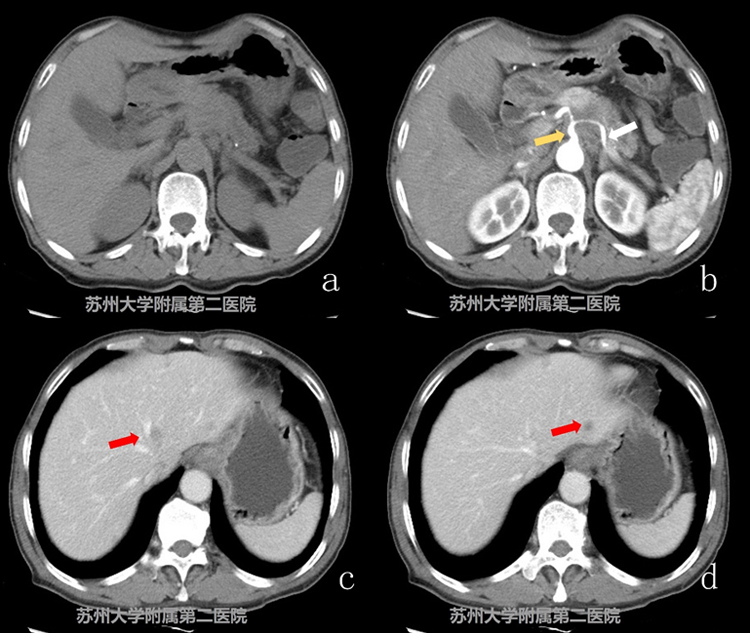
图3-1CT平扫+增强
患者,男性,69岁,考虑胰腺癌。CT平扫胰腺体颈部可见低密度软组织影,增强扫查明显延迟强化,临近腹腔干及其分支受累,肝左叶可见多发转移灶(图3-1腹腔干:黄色箭头;脾动脉:白色箭头;肝脏转移灶:红色箭头)。
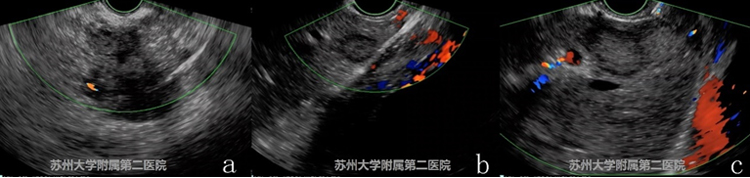
图3-2 EUS
EUS提示胰腺低回声蟹足样生长病灶(图3-2 a),病灶累及腹腔干及其分支,肝左叶可见多发低密度转移灶(图3-2 b和c)。
病例四
判断胰腺癌可切除性是EUS的临床作用之一,因超声内镜可贴近病灶观察,且完整追踪腹部大血管及其分支,故能准确判断病灶和血管的关系,下面病例虽然病灶和血管紧邻,但肿瘤和门脉,脾动静脉呈推挤关系,它们之间的界限始终存在 ,故判断手术可切除(视频1)。
视频1
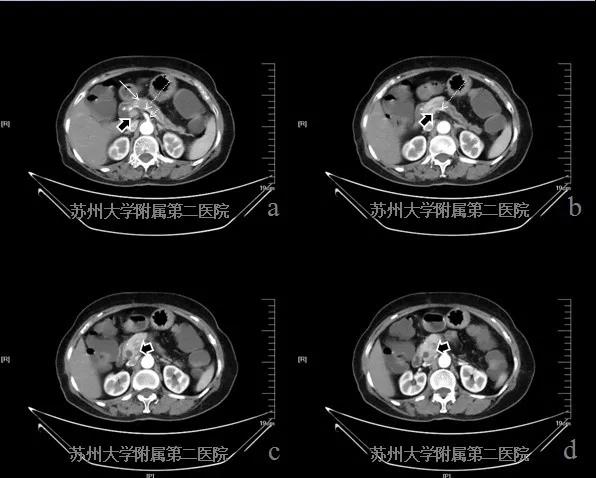
患者,女性,考虑胰腺癌。CT平扫胰腺颈体部可见局部占位,增强扫查病灶呈欠均匀低强化并延长强化,强化程度低于周边正常胰腺组织,病灶远端胰管扩张,CT认为邻近血管受累(图4-1病灶:白色实箭头;腹腔干:细短白色虚箭头;脾动脉:细长白色虚箭头;门静脉:短粗黑实箭头)。
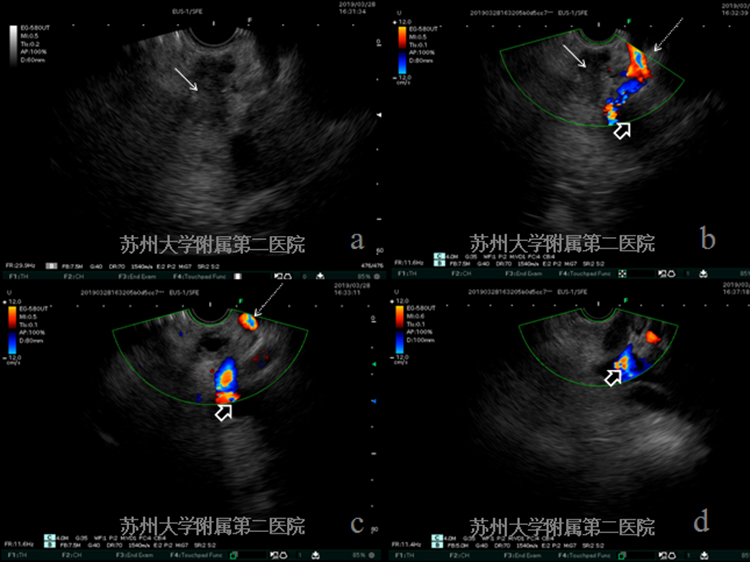
EUS提示胰腺颈部不均匀低回声病灶,连续探查门脉系统及脾动脉、腹腔干,发现血管结构完整、走形连续,未见明显侵犯。(图4-2病灶:白色实箭头;腹腔干:细短白色虚箭头;脾动脉:细长白色虚箭头;脾静脉门静脉系统:短粗黑实箭头)。
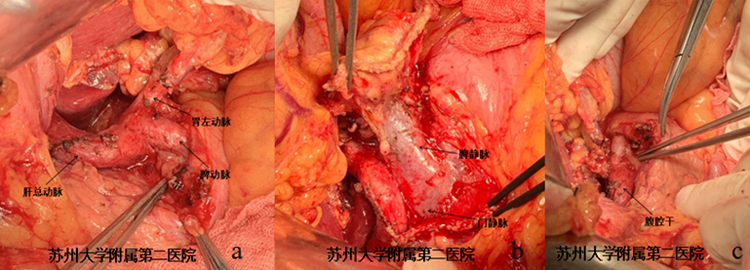
手术中证实该胰腺病灶并未累及邻近血管(图4-3)。连续探查腹部重大血管及其分支亦是初学者需要掌握的技巧之一。
影像学检查确诊典型的胰腺癌,尤其有明显的恶性生物学行为(病灶累及周边组织、血管、门静脉癌栓及肝脏 转移灶)时通常易如反掌,临床上容易被带入“坑”的主要见于以下情况,就连“元老级”的EUS操作者碰到该类病例也会感到迷茫,现将我们操作中遇到的这类病例分享 给大家。
1、早期胰腺癌误诊为神经内分泌肿瘤
早期胰腺癌与胰腺神经内分泌瘤、实性假乳头状瘤混淆。实性假乳头状瘤都有包膜容易与其他两者鉴别,但其余两者鉴别困难,而超声造影为其鉴别的重要措施。
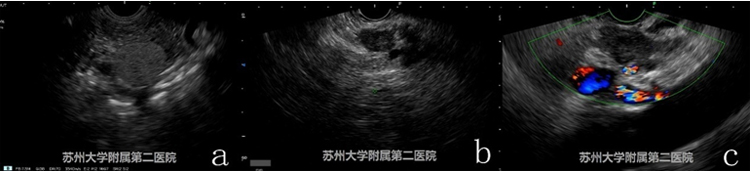
图4-1
这三例患者,图a典型的实性假乳头状瘤(实性成分为主型)超声特点,诊断较为容易;图b和图c我们当时考虑为小胰腺癌,图c我们还实施了EUS-FNA术,穿刺病理HE染色也考虑腺癌。但术后病理证实图c病例为神经内分泌肿瘤。事实上,恶性程度较高、分化较差的胰腺恶性肿瘤,其细胞形态和排列方式与神经内分泌肿瘤十分类似,EUS图像也类似。后期再次回顾图像时,我们可以发现图c中的胰腺神经内分泌瘤EUS回声更低,但这一判断存在主观性差异,所以我们建议辨别困难者可通过超声造影加以鉴别,少数病例只能通过手术后病理方可解开谜底。
2、早期胰腺癌误诊为主胰管型的IPMN
如前期微信与大家分享的那样,不仅神经内分泌肿瘤压迫主胰管时容易误诊,小胰腺癌有时也容易误诊为主胰管型IPMN,超声内镜仔细探查可见胰腺实质内清晰的结节,结节压迫主胰管,而非主胰管内的IPMN
视频2
视频3
这两例病例,CT、MRI均倾向主胰管型IPMN,通过超声探查发现病灶均来源于胰腺实质,视频1已在前期微信与大家分享,起初我们检查完后信心满满的给患者打了小胰腺癌的诊断,但术后病理提示神经内分泌瘤,后期回顾,该患者病灶呈类圆形,回声偏低,仍符合神经内分泌瘤的超声特点。
3、进展期的胰腺癌误诊为自身免疫性胰腺炎
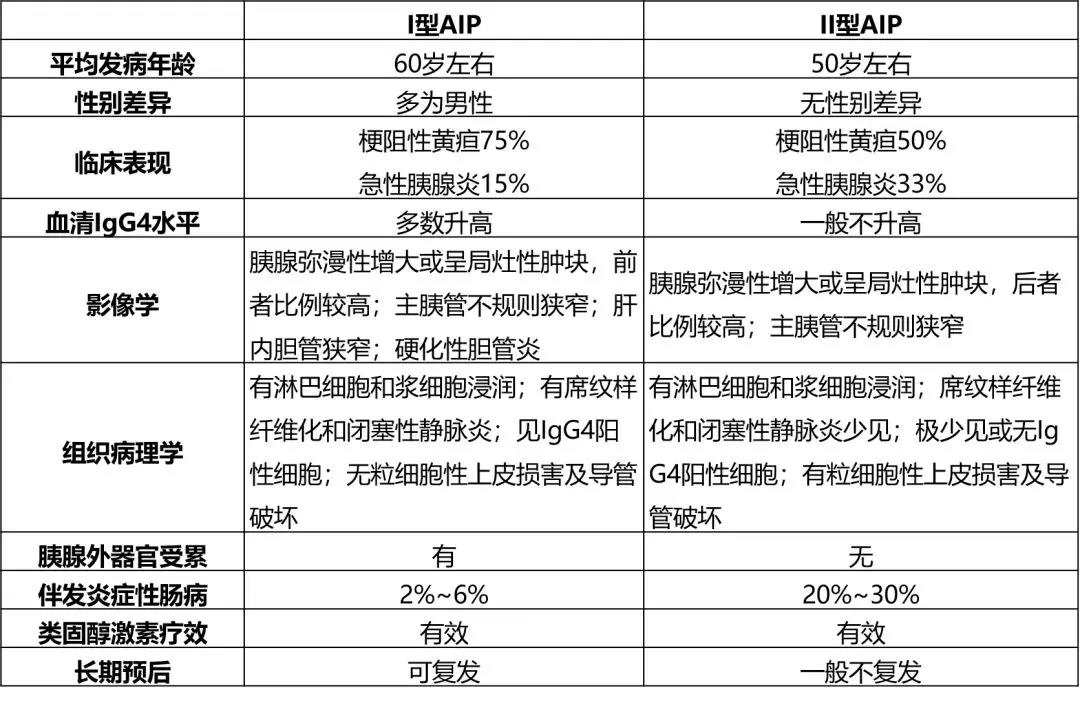
上述的特殊病例毕竟罕见,即便是EUS的高级操作者遇到以上情况也往往无法明察秋毫。对于初学者来说,掌握进展期胰腺癌的典型超声影像学特点即可。事实上,进展期胰腺癌亦容易误诊,尤其与肿块型的自身免疫胰腺炎难以鉴别。自身免疫性胰腺炎可分为两型,其各自特点见表1。
表1:自身免疫性胰腺炎(Auto-Immune Pancreatitis,AIP)临床特点
其中,进展期胰腺癌主要难以与肿块型自身免疫性胰腺炎鉴别,下面分享类似病例。
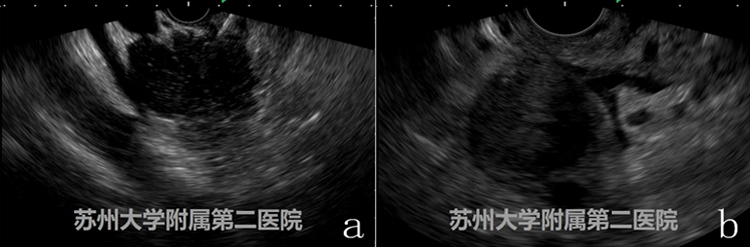
图6
图a病例CT、MRI提示胰头部弥漫性肿大,考虑AIP,图b病例CT、MRI提示胰体尾弥漫性肿大,考虑胰腺癌,当然我们给两位患者分别实施了EUS-FNA,术后验证了影像学诊断的准确性。现在回顾两者的EUS图像仍然非常具有迷惑性,图b的EUS图像与AIP的特点惊人的符合:胰腺弥漫性增大,呈“腊肠样”,回声减低,伴有散在的斑点状高回声,胰腺周边可伴有低回声“包膜样边缘(capsule-likerim)”。在后期的工作中发现碰到类似的病例越来越多,该类病例实施EUS-FNA穿刺可能是最有效的鉴别措施。
4、胰腺结核误诊为进展期胰腺癌
胰腺结核临床少见,EUS表现为边界清楚的低回声占位,病灶往往不规则,有时呈分叶状,没有胰腺癌蟹足样的改变,且胰腺结核的回声更低,EUS-FNB穿刺活检为鉴别诊断的重要手段。
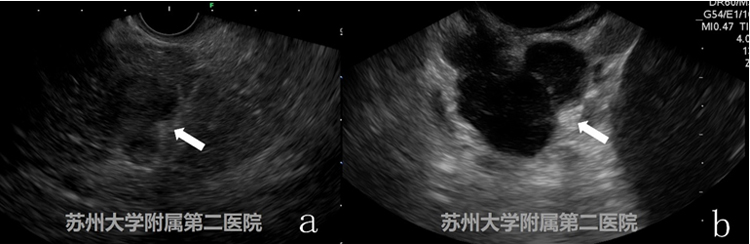
图7
图a为胰腺癌,图b为胰腺结核,其实在我们前期的工作并未遇到过胰腺结核患者,探查完毕后我们仅给出了描述性的诊断,后期给患者实施了EUS-FNB穿刺,确诊了胰腺结核,回顾我们的病例及相关文献,可以发现胰腺结核EUS图像界限清晰,回声偏低,而胰腺癌则边界模糊。
这期微信与大家分享了EUS探查及EUS-FNA中最常见的疾病---胰 腺癌,当我们越过EUS漫长的学习曲线平台期,后面的病例积累阶段将更加漫长,只有 积累了大量的病例才能在EUS诊断中游刃有余。
声明
富士胶片内镜世界(LIFE World)所登载的内容及其版权和使用权归作者本人与富士胶片所有。如发现会员擅自复制、更改、公开发表或其他以盈利为目的的使用,富士胶片将追究其法律责任。网站信息中涉及的治疗手技皆为术者个人针对该名患者特定体质及健康状况所采取的手法;术者对器械和药品种类的选择,也受到手术发生时间、地点等诸多因素的影响。因而相关内容及信息仅供会员参考。如盲目使用网站信息中涉及的治疗手技而发生意外,恕富士胶片及本网站对此不承担任何责任。

推荐内容
-
胰2024/07/27经典超声内镜病例:胰周Castleman病Castleman病(Castleman Disease , CD)1954年首次被报道,又称巨大淋巴结病或血管滤泡淋巴结增生症,可发生于全身各个部位,是一种罕见的淋巴增殖性疾病。据文献报道,70%的CD位于胸部淋巴结,其次是颈部(15%)、腹盆(12%)和腋窝(3%)淋巴结。CD缺乏特异性临床表现及影像学特征,易被误诊。本期和大家探讨一下CD的影像学表现,下面是我们中心最近遇到的两例胰周CD患者。
-
胰2022/03/22经典超声内镜病例:Wirsungocele-腹侧胰管末端囊肿主胰管(main pancreatic duct MPD)在胚胎第8周由背侧胰管(Santorini)和腹侧胰管(Wirsung)融合而成。融合后,Santorini管近侧段多数在胎儿期自发闭锁、消失。亦有约44%的个体,近侧段Santorini管持续开放,形成了副胰管,但管径较小(通常比Wirsung管管径小1毫米)。MPD管径自胰尾到胰头逐渐增粗,边缘光滑,2-3mm左右,其走行在MRCP可表现为为四型:下降型、S型、垂直型及环型(图1)。
-
胰2021/12/06经典超声内镜病例:假肿瘤性胰腺炎作为临床医生,看到以下两张CT图(图1),我想大多数人脑海里快速浮现的诊断便是胰腺癌。然而,有一种慢性胰腺炎,其临床表现及影像学下特征与胰腺癌极其相似,故而被称为假肿瘤性胰腺炎(Pseudotumoral Chronic Pancreatitis PCP)。PCP占慢性胰腺炎的10%~36%,病灶多位于胰头部,亦可称之为节段性慢性胰腺炎,局灶性胰腺炎、炎性肿块、肿块型胰腺炎。国外以慢性酒精中毒为主要原因;国内以胆源性为主,其他原因还包括高血脂、遗传性和自身免疫异常。临床极易与胰腺癌相混淆,但两者的治疗和预后截然不同,如何将其准确辨认成为临床重点和难点。既往文献报道,传统影像学可通过胰腺实质声像、胆胰管变化方式以及其嗜血管和神经特性等多方面特征进行鉴别(图2)。
-
胰2021/09/15经典超声内镜病例:自身免疫性胰腺炎自身免疫性胰腺炎(autoimmune pancreatitis AIP)是由自身免疫介导,以胰腺肿大(弥漫性或局灶性)和胰管不规则狭窄为特征的一种特殊类型的慢性胰腺炎。AIP有两种不同的亚型:1型和2型。1型AIP也被称为淋巴浆细胞硬化性胰腺炎(LPSP),是全身疾病过程的胰腺表现,称为免疫球蛋白G4(IgG4)相关疾病(IgG4-RD);2型AIP也称为特发性导管中心性胰腺炎(IDCP)。其中1型AIP更为常见,好发于亚洲老年男性,多伴有IgG4水平升高,对激素治疗反应好。II型好发于欧美国家,对激素治疗有争议。本文主要介绍I型AIP。两者的详细鉴别见表1。
-
胰2021/05/10经典超声内镜病例:胰腺脂肪性病变随着多模态成像技术的广泛应用,胰腺病灶的发现率逐年增高,既往的少见病变也报道的越来越频繁。胰腺肿瘤中,85%为上皮源性肿瘤(腺癌等),除此,还有1-2%的来源于间叶组织,这些间叶来源病变成份多样、良恶兼有(图1)。日益增多的胰腺“少见病”无疑对EUS术者提出更高的要求,本期分享给大家的是并不少见的“少见病”-----胰腺脂肪性病变
-
胰2020/12/16经典超声内镜病例:EUS引导下胰腺细针纹身术社会多元化的今天,纹身并不罕见,一些前卫青年甚至将其纹于臀部、乳房等私密处,但很少有人听说纹身在胰腺上吧,这并不是“危言耸听”,最新一期《Endoscopic Ultrasound》上专门介绍如何做好胰腺纹身(EUS-guilding pancreatic tattooing),这究竟是什么样的一项技术,有哪些适应症,今天我们就来聊一聊它。