
图1-3 EUS结果
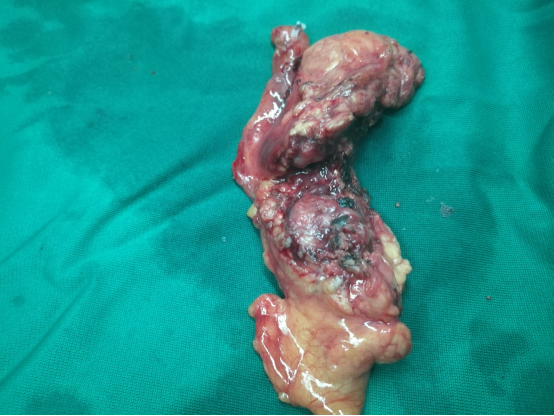
图1-4 大体标本
病例二
26岁女性患者,因体检发现胰腺颈部占位住院。CT提示胰颈部见结节状低密度影,其内见小斑片状更低密度影,界限不清,增强扫面呈渐进性强化(图2-1;白色箭头:病灶);MRI提示胰腺颈部见一类圆形T2WI外周高中央低、T1WI低信号灶,增强扫描见病灶动脉期欠均匀强化、静脉期及延迟期渐进性强化(图2-2;白色箭头:病灶);EUS提示胰颈圆形低回声病灶,界限清晰(视频2-1、图2-3)。患者行开放性胰颈、体尾切除术,术后大体标本及病理提示化:实性假乳头状瘤(图2-3;白色箭头:病灶)。
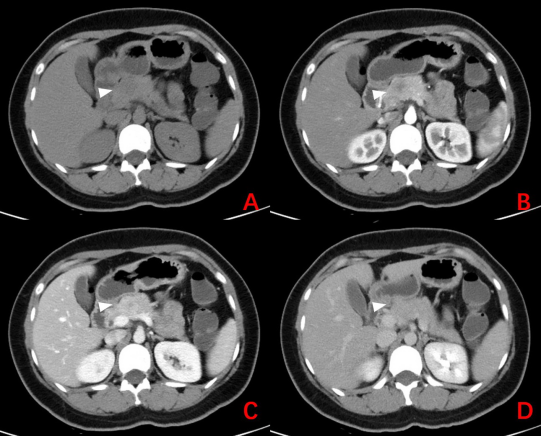
图2-1 CT增强扫描结果
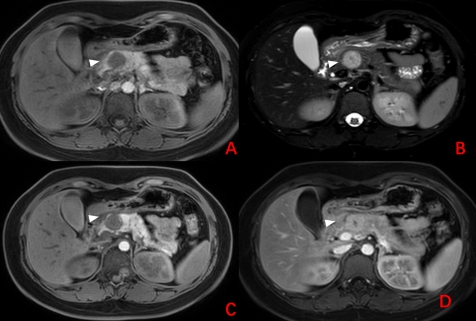
图2-2 MRI结果
视频2-1:
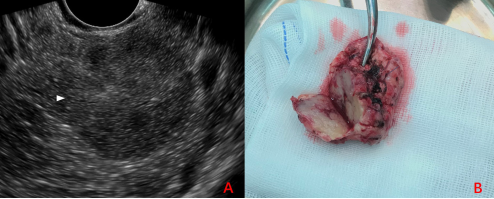
图2-3 EUS及大体标本
病例三
25岁女性患者,因体检发现胰头占位住院。CT平扫胰腺头部可见类圆形肿块影,其内密度不均,肿块突出胰腺轮廓之外,可见包膜。增强扫描可见肿块内斑片状等密度影呈中度强化,其内低密度影未见强化,肿块包膜可见明显强化,与邻近组织分界清(图3-1;白色箭头:病灶);
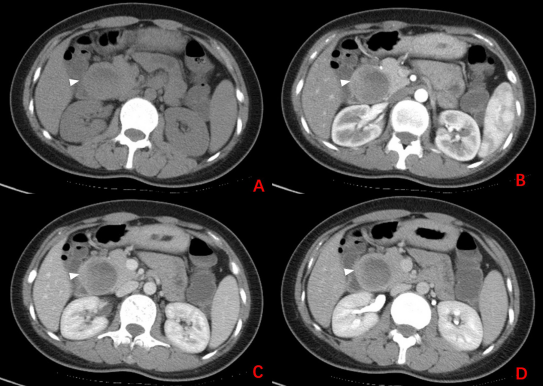
图3-1 CT结果
MRI提示胰头部见一包膜完整的团块异常信号灶,信号混杂,呈等低信号,病灶不与主胰管、分支胰管相通。病灶T2WI呈分层现象,右侧和背侧呈T2WI稍高、T1WI等低信号,左侧和腹侧呈T2WI高、TIWI等信号(图3-2;白色箭头:病灶);
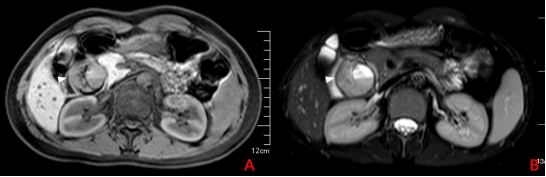
图3-2 MRI结果
超声内镜探查见胰头部一类圆形病灶,内部呈囊实性改变,因病灶位于胰头部,谨慎起见我们为该患者实施了EUS-FNA(图3-3;M:病灶;紫色箭头:实性成分;黄色箭头:囊性成分)。
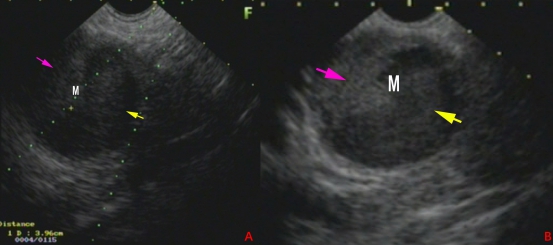
图3-3 EUS结果
穿刺病理见腺体部分呈乳头状结构,提示胰腺假实性乳头状瘤可能性大(图3-4),后进一步行手术治疗,术后标本、术中快速病理及术后病理均证实为实性假乳头肿瘤(图3-5)、(图3-6;免疫组化提示:A图β-catenin+、B图vimentin+、C图sy+、D图CagA-)。
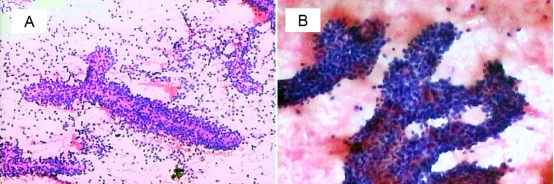
图3-4 穿刺病理
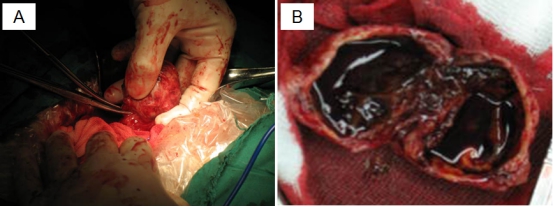
图3-5 术中、术后病理
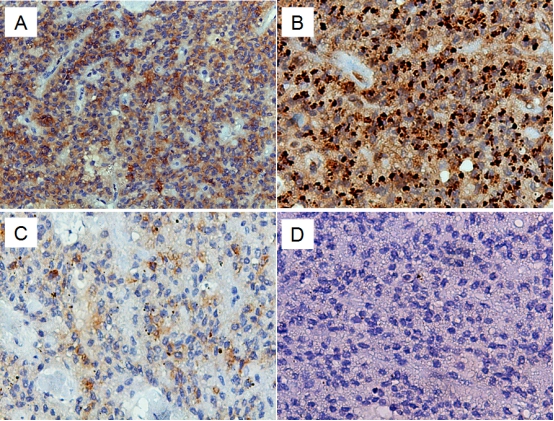
图3-6 免疫组化结果
病例四
30岁男性患者,因左上腹隐痛住院。CT提示胰颈部囊实性病灶,轮廓清晰,突出于胰腺轮廓之外,增强扫描可见囊壁较厚,实性成分渐进性强化,压迫后方门静脉(图4-1);MRI提示病灶包膜完整,与正常胰腺实质分界清晰,呈团块状混杂信号影,以 T2W-SPAIR高信号、T1WI低信号为主,增强扫描见内部实性成分轻度强化(图4-2);EUS提示胰颈部囊实性病灶,但囊性成分为主,病灶压迫门静脉;术后病理提示实性假乳头状瘤(视频4-1、图4-3;白色箭头:病灶;黄色箭头:实性成分),后行全麻下行腹腔镜探查术+开放性胰体尾切除术,术后大体标本及病理提示化:实性假乳头状瘤(图4-3)。
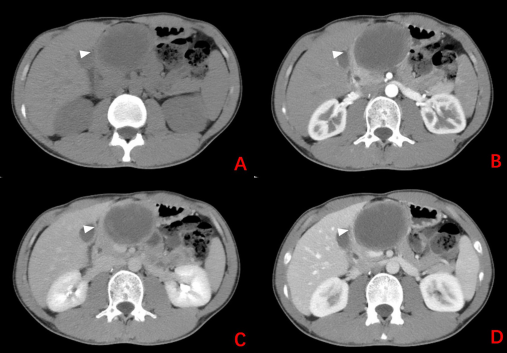
图4-1 CT增强扫描结果
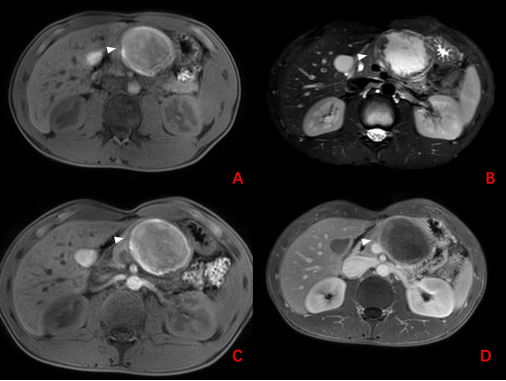
图4-2 MRI结果
视频4-1:
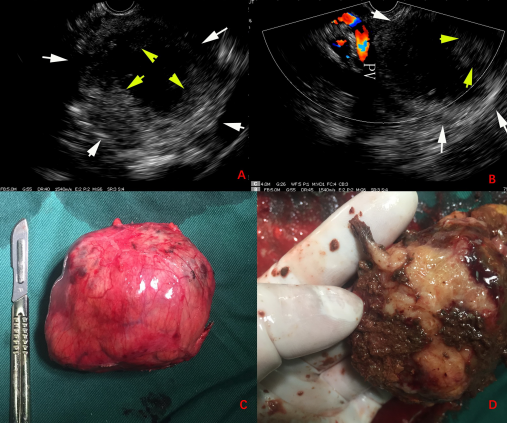
图4-3 EUS及大体标本
正如我们展示的四例病例一样,胰腺实性假乳头状瘤超声内镜图异质性较大,内部坏死程度的不同可呈实性、囊实性或完全囊性改变,但病灶一定会有明显的包膜。
实性成分为主型表现为低回声的圆形病灶,主要与早期胰腺癌、胰腺神经内分泌肿瘤鉴别,但后两者回声更低(图5-1;A图:实性假乳头状瘤;B图:实性假乳头状瘤;C图:胰腺癌;D图:神经内分泌肿瘤),且因实性假乳头状瘤内部呈乳头状,其结构较神经内分泌肿瘤松散,故病灶有一定的“柔性”,缺少“紧致感”,表现为探头压迫时有一定程度的变形。
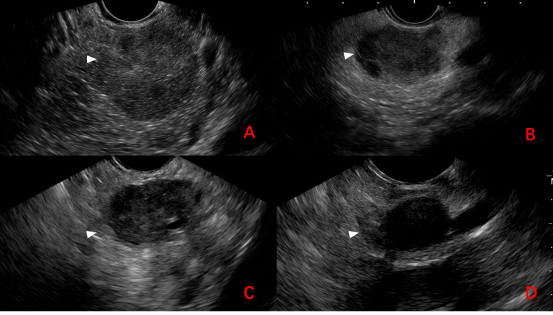
图5-1 病灶回声对比
在实施EUS-FNA穿刺时更能体现上述表现,即穿刺实性成分为主型SPN时如同穿刺“棉花糖”的感觉,而穿刺神经内分泌肿瘤时如同穿刺“土豆”的感觉;囊实成分相间型、囊性成分为主型需鉴别的主要由胰腺黏液性囊腺瘤、胰腺癌伴坏死、神经内分泌瘤伴坏死,后者多无包膜,且极少表现为规则的圆形病灶,鉴别困难的可实施EUS-FNA穿刺。
SPN组织学特征主要是由实性区、假乳头区和囊性区构成。在实性区,肿瘤细胞排列成实性巢片状、假乳头状或导管样,被纤细的小血管分隔。一层或多层肿瘤细胞围绕纤维血管轴心形成假乳头区。囊性区为纤维组织构成的囊壁,常变性、坏死、脱落形成。鉴别困难的可进一步行免疫组化检查,免疫组化检查时可发现 vimentin,AAT、NSE、CD10呈弥漫阳性,部分肿瘤细胞表达S200、CK、CgA、Syn、PR,ER,胰酶、CA19-9、CEA阴性。
目前手术切除是SPN首选的治疗方法,也是唯一方法。由于SPN好发于年轻人、肿瘤生物学呈低度恶性,且常具有完整包膜,患者多尽可能行单纯肿物切除术或局部切除。手术方式的选择应根据术中快速病理的结果、肿瘤的部位、肿块大小及其侵袭的范围来决定。SPN预后良好,术后一般不主张化疗和放疗。
参考文献
(1)胰腺囊性疾病诊治指南.中国实用外科杂志2015,35(9):955-959.
(2)ACG clinical guideline:diagnosis and management of pancreatic cysts:Am J Gastroenterol. 2018 Feb 27.
(3)我国胰腺囊性肿瘤共识意见(草案2013,上海):中华胰腺病杂志.2013,13(2).79-91.
作者丨程桂莲,吴伟,徐丽明,胡端敏
来源丨苏州大学附属第二医院消化科
前一期与大家分享了胰腺导管内乳头状黏液性肿瘤(intraductal papillary mucinous neoplasm,IPMN)的超声内镜图像特点,今天继续与大家分享一类罕见的胰腺囊性肿瘤---实性假乳头状瘤(solid pseudopapillary neoplasm,SPN)的超声内镜图像特点。它的发生率仅占所有胰腺外分泌肿瘤的0.17-2.7%,多单发,胰腺各部位均可发生,瘤体往往位于胰腺实质边缘,突出于胰腺轮廓之外,边界多清晰,较少导致胆总管、主胰管扩张,多数为低度恶性肿瘤,10%-15%可发生肝脏或腹膜转移,但淋巴结转移少见,约1/3可见钙化。
瘤体较小者,多为实性,称为实性成分为主型;瘤体大者多为囊实性,其囊性成分多由囊内出血和肿瘤组织退变坏死形成,称为囊实成分相间型;部分可呈高度囊性变,仅在囊壁上残余薄层肿瘤组织,称囊性成分为主型。
CT平扫典型征象为单发的、边界清晰、包裹良好、质地不均、血管密度低的占位病变,约1/3可见钙化,但因病灶CT值接近胰腺,病灶较小时,平扫检查时容易漏诊。部分瘤体因中央坏死变性、继发性出血使病灶呈囊实性。CT增强扫查时早期实质部分轻度强化,静脉及延迟期渐进中度强化,但低于周边胰腺密度,病灶呈囊实性时囊壁较厚并强化,部分囊壁呈结节或呈乳头状突起。
MRI平扫见胰腺实质内边界清晰的软组织肿块,T1WI呈等低信号,T2WI呈等高信号,病灶合并坏死时,呈囊实性改变,MRI下则呈混杂信号,囊性部分T1WI低信号,T2WI高信号,实性部分信号多变,可多种信号混杂出现,出血部分T1WI高信号,T2WI呈低信号;增强扫查时实性成分轻度强化,囊性成分不强化。EUS典型征象为单发的、边界清晰、圆形、包裹良好、实性低回声的异质性肿块,其后方呈强回声;病灶较大时中央坏死伴出血,超声下则为囊实性。瘤体较小时,多为低回声的实性病灶;较大者多表现为囊实性占位,甚至呈高度囊性变。
下面与大家分享我们超声内镜工作中发现的四例胰腺实性假乳头状瘤的影像学特点,其中3例为女性,1例为男性,年龄位于25-40岁之间。
病例一
40岁女性患者,因腹痛就诊。查B超示胰腺占位性病变;CT平扫病灶不明显,但增强后动脉期胰体见低密度病灶,与周边胰腺实质分界清晰(图1-1;白色箭头:病灶);MRI提示病灶T2WI呈高信号、T1WI呈等低信号,病灶不与主胰管、分支胰管相通(图1-2;白色箭头:病灶);EUS提示胰体轮廓清晰的圆形低回声病灶,内部回声均匀,病灶不与胰管相通,内部血流不丰富(视频1-1、图1-3);术后大体标本及病理提示实性假乳头状瘤(图1-4)。
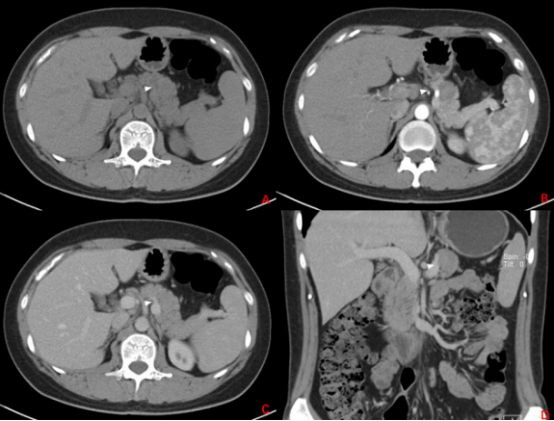
图1-1 CT结果
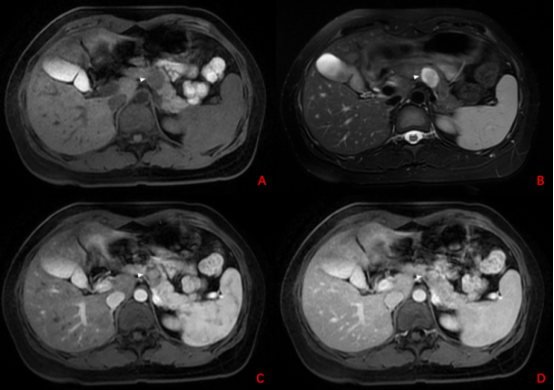
图1-2 MRI结果
视频1:

图1-3 EUS结果

图1-4 大体标本
病例二
26岁女性患者,因体检发现胰腺颈部占位住院。CT提示胰颈部见结节状低密度影,其内见小斑片状更低密度影,界限不清,增强扫面呈渐进性强化(图2-1;白色箭头:病灶);MRI提示胰腺颈部见一类圆形T2WI外周高中央低、T1WI低信号灶,增强扫描见病灶动脉期欠均匀强化、静脉期及延迟期渐进性强化(图2-2;白色箭头:病灶);EUS提示胰颈圆形低回声病灶,界限清晰(视频2-1、图2-3)。患者行开放性胰颈、体尾切除术,术后大体标本及病理提示化:实性假乳头状瘤(图2-3;白色箭头:病灶)。

图2-1 CT增强扫描结果

图2-2 MRI结果
视频2-1:

图2-3 EUS及大体标本
病例三
25岁女性患者,因体检发现胰头占位住院。CT平扫胰腺头部可见类圆形肿块影,其内密度不均,肿块突出胰腺轮廓之外,可见包膜。增强扫描可见肿块内斑片状等密度影呈中度强化,其内低密度影未见强化,肿块包膜可见明显强化,与邻近组织分界清(图3-1;白色箭头:病灶);

图3-1 CT结果
MRI提示胰头部见一包膜完整的团块异常信号灶,信号混杂,呈等低信号,病灶不与主胰管、分支胰管相通。病灶T2WI呈分层现象,右侧和背侧呈T2WI稍高、T1WI等低信号,左侧和腹侧呈T2WI高、TIWI等信号(图3-2;白色箭头:病灶);

图3-2 MRI结果
超声内镜探查见胰头部一类圆形病灶,内部呈囊实性改变,因病灶位于胰头部,谨慎起见我们为该患者实施了EUS-FNA(图3-3;M:病灶;紫色箭头:实性成分;黄色箭头:囊性成分)。

图3-3 EUS结果
穿刺病理见腺体部分呈乳头状结构,提示胰腺假实性乳头状瘤可能性大(图3-4),后进一步行手术治疗,术后标本、术中快速病理及术后病理均证实为实性假乳头肿瘤(图3-5)、(图3-6;免疫组化提示:A图β-catenin+、B图vimentin+、C图sy+、D图CagA-)。

图3-4 穿刺病理

图3-5 术中、术后病理

图3-6 免疫组化结果
病例四
30岁男性患者,因左上腹隐痛住院。CT提示胰颈部囊实性病灶,轮廓清晰,突出于胰腺轮廓之外,增强扫描可见囊壁较厚,实性成分渐进性强化,压迫后方门静脉(图4-1);MRI提示病灶包膜完整,与正常胰腺实质分界清晰,呈团块状混杂信号影,以 T2W-SPAIR高信号、T1WI低信号为主,增强扫描见内部实性成分轻度强化(图4-2);EUS提示胰颈部囊实性病灶,但囊性成分为主,病灶压迫门静脉;术后病理提示实性假乳头状瘤(视频4-1、图4-3;白色箭头:病灶;黄色箭头:实性成分),后行全麻下行腹腔镜探查术+开放性胰体尾切除术,术后大体标本及病理提示化:实性假乳头状瘤(图4-3)。

图4-1 CT增强扫描结果

图4-2 MRI结果
视频4-1:

图4-3 EUS及大体标本
正如我们展示的四例病例一样,胰腺实性假乳头状瘤超声内镜图异质性较大,内部坏死程度的不同可呈实性、囊实性或完全囊性改变,但病灶一定会有明显的包膜。
实性成分为主型表现为低回声的圆形病灶,主要与早期胰腺癌、胰腺神经内分泌肿瘤鉴别,但后两者回声更低(图5-1;A图:实性假乳头状瘤;B图:实性假乳头状瘤;C图:胰腺癌;D图:神经内分泌肿瘤),且因实性假乳头状瘤内部呈乳头状,其结构较神经内分泌肿瘤松散,故病灶有一定的“柔性”,缺少“紧致感”,表现为探头压迫时有一定程度的变形。

图5-1 病灶回声对比
在实施EUS-FNA穿刺时更能体现上述表现,即穿刺实性成分为主型SPN时如同穿刺“棉花糖”的感觉,而穿刺神经内分泌肿瘤时如同穿刺“土豆”的感觉;囊实成分相间型、囊性成分为主型需鉴别的主要由胰腺黏液性囊腺瘤、胰腺癌伴坏死、神经内分泌瘤伴坏死,后者多无包膜,且极少表现为规则的圆形病灶,鉴别困难的可实施EUS-FNA穿刺。
SPN组织学特征主要是由实性区、假乳头区和囊性区构成。在实性区,肿瘤细胞排列成实性巢片状、假乳头状或导管样,被纤细的小血管分隔。一层或多层肿瘤细胞围绕纤维血管轴心形成假乳头区。囊性区为纤维组织构成的囊壁,常变性、坏死、脱落形成。鉴别困难的可进一步行免疫组化检查,免疫组化检查时可发现 vimentin,AAT、NSE、CD10呈弥漫阳性,部分肿瘤细胞表达S200、CK、CgA、Syn、PR,ER,胰酶、CA19-9、CEA阴性。
目前手术切除是SPN首选的治疗方法,也是唯一方法。由于SPN好发于年轻人、肿瘤生物学呈低度恶性,且常具有完整包膜,患者多尽可能行单纯肿物切除术或局部切除。手术方式的选择应根据术中快速病理的结果、肿瘤的部位、肿块大小及其侵袭的范围来决定。SPN预后良好,术后一般不主张化疗和放疗。
参考文献
(1)胰腺囊性疾病诊治指南.中国实用外科杂志2015,35(9):955-959.
(2)ACG clinical guideline:diagnosis and management of pancreatic cysts:Am J Gastroenterol. 2018 Feb 27.
(3)我国胰腺囊性肿瘤共识意见(草案2013,上海):中华胰腺病杂志.2013,13(2).79-91.