程桂莲 吴伟 徐丽明 胡端敏
苏州大学附属第二医院 消化科
Castleman病(Castleman Disease , CD)1954年首次被报道,又称巨大淋巴结病或血管滤泡淋巴结增生症,可发生于全身各个部位,是一种罕见的淋巴增殖性疾病。据文献报道,70%的CD位于胸部淋巴结,其次是颈部(15%)、腹盆(12%)和腋窝(3%)淋巴结。CD缺乏特异性临床表现及影像学特征,易被误诊。本期和大家探讨一下CD的影像学表现,下面是我们中心最近遇到的两例胰周CD患者。
病例一
青年女性,既往体健,MRI及CT提示:胰腺后方占位,考虑1)巨淋巴细胞增生症;2)淋巴瘤待排。入院后完善相关检查,排除禁忌症后拟行EUS-FNA,EUS示胰腺钩突区异常回声,边界清晰,内部见筛孔样结构,予22G针穿刺活检,病理提示淋巴组织增生性病变,未见恶性肿瘤细胞。结合病史、影像学表现及病理,临床诊断CD,建议手术,术后病理证实CD(浆细胞亚型)(图1)
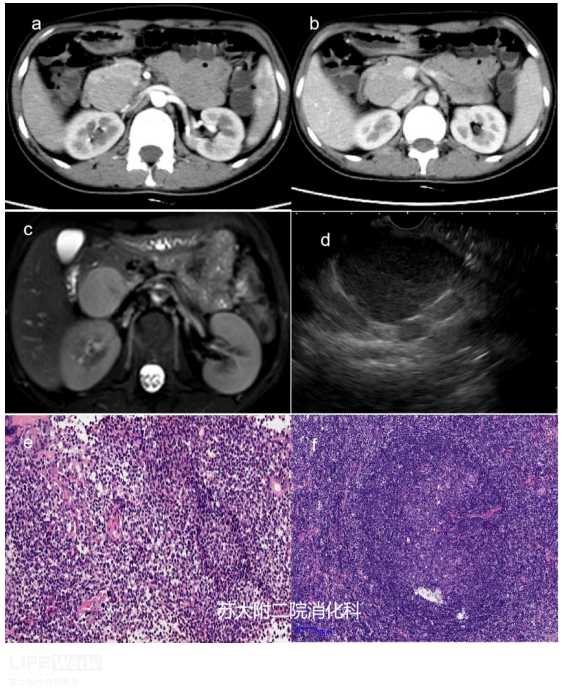
图1:a-b :动脉期及门脉期可见胰头下方见团块状软组织密度影、边界清晰、与同层胰腺呈稍等或略低程度强化模式;c:MRI下T2呈稍高信号;e、f:分别为低倍镜下FNA及手术大体病理
病例二
老年女性,2019年体检CT发现肝尾状叶占位,考虑:血管平滑肌脂肪瘤;胰头增大伴肿块样凸起,考虑胰头分叶(形态变异)可能。2021年因肺部疾病完善胸部CT,胰头病灶似乎有所增大。故而行EUS检查,肝尾状叶见团块状、边界清晰、高回声病变(视频1);胰头区域见边界清晰、组织致密、均匀低回声病灶,超声造影增强观察为富血供病灶,呈快进慢出表现(视频2),考虑非上皮神经内分泌肿瘤待排,建议完善术前检查后拟行FNA。后患者选择外科肝叶+胰头病灶切除术,术后病理证实:肝血管平滑肌脂肪瘤;腹腔胰周CD(透明血管型)。
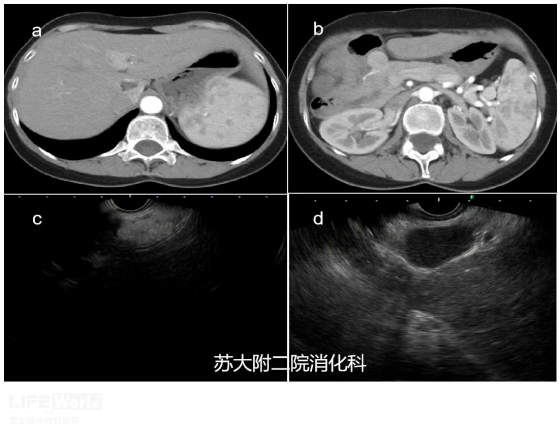
图2:a、b: CT下可见肝尾状叶病变及胰头结节状凸起;c: EUS下肝左叶见团块状高回声影;d: 胰头见边界清晰、均匀低回声病灶
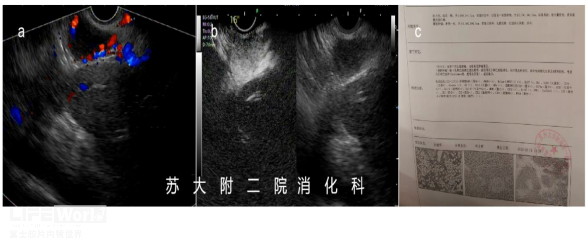
图3:a: 病灶呈富血供表现;b: 动脉期病灶呈强化模式;c: 外院手术报告
视频1
视频2
尽管本中心两例CD在病理获取上存在一定遗憾,但给我们带来了很多思考:如CD在EUS上是否具有特征性改变、EUS-FNA在CD诊断中价值如何等,带着这些疑问,我们复习了相关文献并总结如下:
由于CD临床表现不一、病理类型多样、可累及任何部位,又是一种少见疾病,因此常被误诊为相应部位的良恶性肿瘤。CD根据淋巴结受累区域可分为:单中心型CD(unicentric CD, UCD 90%)和多中心型CD(multicentric CD, MCD 10%);根据病理形态分为透明血管型 CD(hyaline vascular subtype of CD, HV-CD)、浆细胞型CD(plasma cell subtype of CD, PC-CD)及混合型CD(mixed type of CD)。MCD患者除淋巴结肿大外,往往还伴有发热、盗汗、乏力、体重下降、贫血、肝功能不全、肾功能不全、容量负荷过多(全身水肿、胸水、腹水等)等全身表现,相对易诊断。而大多数UCD 患者无伴随症状,特别是发生于胸腹腔深部区域,组织获取困难,临床诊断十分棘手。胰周CD更为罕见,容易被误诊为胰腺富血供病灶,如神经内分泌肿瘤或淋巴瘤,因不同疾病的治疗方式迥异,鉴别胰周UCD与其他富血供病变的意义重大。
EUS及其相关技术是鉴别胰腺良、恶性疾病的利器,对胰周病变,同样具有“近水楼台”的优势。熟悉胰周CD的疾病特征将有助于EUS诊断水平的提高。尽管CD缺乏特征性改变,仍有学者在不断的总结,研究者提出以下特征更支持CD(尤其是HV-CD):a、单一病变;b、圆形或准圆形,边缘清晰;c、均匀低回声,透射性好;d.内部高回声钙化;f.多普勒显示血流信号丰富;g. 明显和持续强化。然除钙化外,其他特征同样可出现在淋巴瘤、嗜铬细胞瘤等富血供病变中,下面是本中心曾遇到的相似强化模式的淋巴瘤及嗜铬细胞(视频3、4),故而定性诊断仍需病理证实。
视频3 弥漫大B淋巴瘤造影视频
视频4:嗜铬细胞瘤造影视频
CD的病理确诊依赖于充足的组织标本,病灶完整切除是最理想方式。然而,胸、腹腔深部病灶手术创伤性大,疗效不确切,因此穿刺活检是首选方式。相对于传统的经皮穿刺,EUS-FNA对于胰周病变的优势毋庸置疑。据文献报道,一共有12例胰周CD进行了术前穿刺,由于对疾病认知的有限,大部分FNA无法作出明确诊断,基本提示为淋巴组织增生性疾病,少数误诊为淋巴瘤等其他疾病,只有2例确诊为CD。第一例为Khashab MA等学者2011年在Endoscopy 发表的case,文中EUS提示胰腺上方可见一边界清晰、富血供及内部含钙化灶病变,FNA细胞学提示:在多形淋巴细胞背景下,可见部分完整的淋巴滤泡及毛细血管穿透其中,故而诊断CD,术后大体病理可见“洋葱皮”样改变,支持HV-CD(图4)。 其次,Nayak等人2022年在Pancreatology 报道第二例经EUS-FNB(endoscopic ultrasonography guided fine needle biopsy)确诊胰周CD,文献中病灶显示出花环样的血管影,FNB标本200x显微镜下可见部分血块、大量成熟淋巴细胞及“洋葱皮”样改变;400x高倍镜下可见血管穿透于滤泡中央,血管壁透明化,可见钙化灶;免疫组织化提示CD23阳性,更突显出“洋葱皮”样外观,符合HV-CD病理特征(图5)。尽管目前文献报道EUS-FNA在胰周CD的总体诊断准确性方面不理想,但从以上两个病例可见,FNB所获得的组织明显更充分。随着对该疾病认知的提升,在临床资料、传统影像辅助、相对特征性声像学改变的提示以及穿刺针内径的不断改进下,EUS及相关技术将成为胰周CD术前诊断的有价值技术。
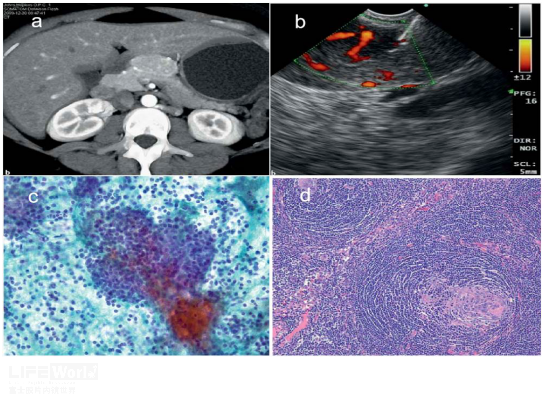
图4:a、CT下胰头上方见富血供病灶;b、EUS病灶血流信号丰富;c、在多形淋巴细胞背景下,可见部分完整的淋巴滤泡及毛细血管穿透其中;d、术后大体病理;图片来自文献Khashab MA, et al. A rare case of peripancreatic Castleman's disease diagnosed preoperatively by endoscopic ultrasound-guided fine needle aspiration. Endoscopy. 2011
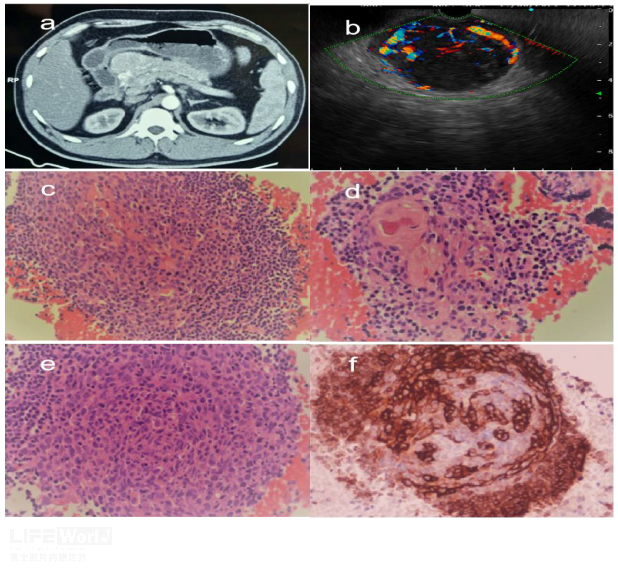
图5 a、胰头上方见富血供病灶;b、EUS下病灶呈花环样血流信号;c、200x显微镜下可见部分血块、大量成熟淋巴细胞及“洋葱皮”样改变;d、400x高倍镜下可见血管穿透于滤泡中央,血管壁透明化,可见钙化灶;e、200x“洋葱皮”样改变g、免疫组织化提示CD23阳性,更突显出“洋葱皮”样外观。图片来自Nayak HK, Pattnaik B, Patra S, et al. Pancreatic Castleman's disease: Ring of fire sign and endoscopic ultrasonography guided fine-needle biopsy helps preoperative diagnosis[J]. Pancreatology, 2022
最后,我们学习下CD的治疗及预后,UCD预后良好,手术后几乎不影响远期生存,5年生存率超过90%。MCD尤其是特发性MCD(idiopathic MCD, iMCD)预后较差。因此,治疗前应对患者进行症状、影像学检查、鉴别诊断相关检查、炎症状态及器官损伤评估四个维度的全面评估,以确定患者分型及严重程度。根据中国Castleman病诊断与治疗专家共识(2021版)指导,CD具体治疗流程见下图:
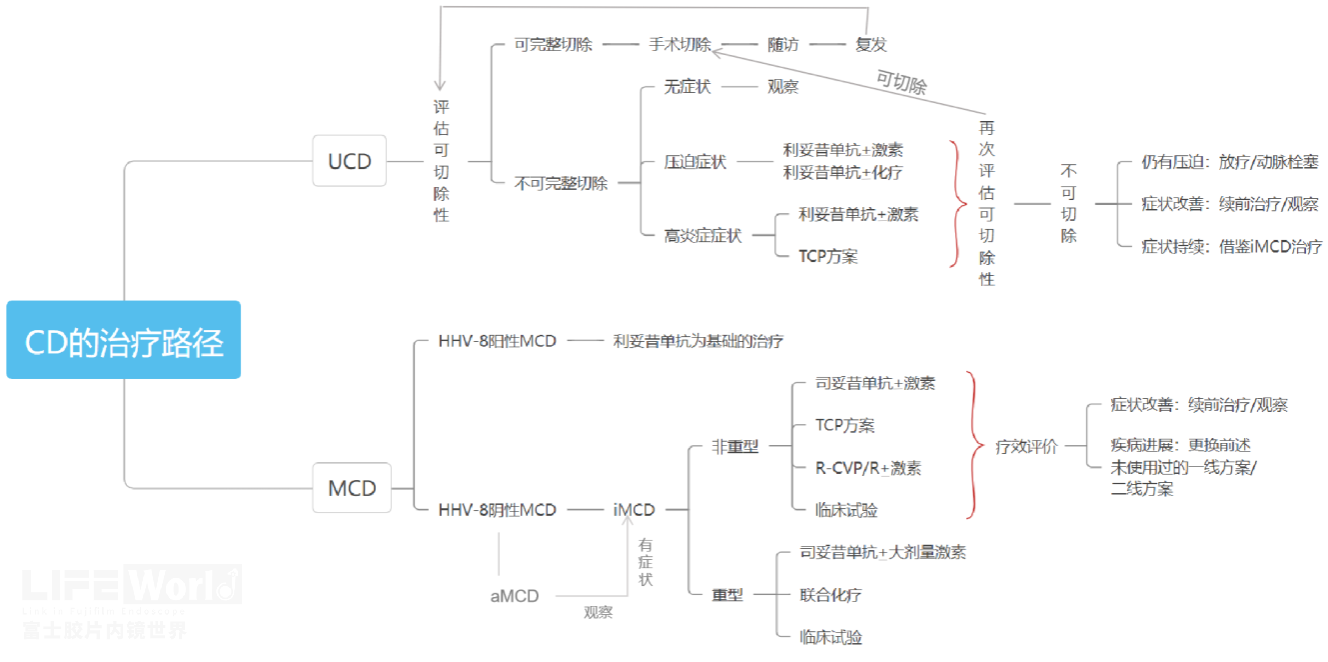
图5:CD治疗路径图(aMCD:无症状性多中心型 Castleman病; iMCD:特发性多中心型 Castleman病; HHV-8:人类疱疹病毒 8 型; TCP:沙度利安+环磷酰胺+泼尼松; R:利妥昔单抗; R-CVP:利妥昔单抗+环磷酰胺+长春新碱+泼尼松; 激素:糖皮质激素)
笔者之所以执笔这一期文章,是想让更多的EUS“超人”们认识这个疾病,进一步提高EUS的诊断水平。因CD是一种罕见的血液疾病,发病率低,在国内较罕见且认知度低,但中国人口基数庞大,其患病人群并不少。故而,EUS操作过程中一旦遇到边界清晰、回声均匀、内部散在钙化及富血供病灶,在鉴别诊断中需考虑到此病。鉴于CD的病理诊断要求,尽可能选取FNB针以便获取更多的结构性组织,同时结合临床及实验室结果进行综合性诊断,从而给予患者最精准的治疗指导。
参考文献
1. Hamel C, Avard B, Belanger C, et al. Canadian Association of Radiologists Gastrointestinal Imaging Referral Guideline[J]. Can Assoc Radiol J, 2024:8465371231217230.
2. Han Z, Han X, Li Y, et al. EUS in the diagnosis of peripancreatic Castleman disease: A case report (with video)[J]. Endosc Ultrasound, 2023,12(2):281-283.
3. Liu AY, Nabel CS, Finkelman BS, et al. Idiopathic multicentric Castleman's disease: a systematic literature review[J]. Lancet Haematol, 2016,3(4):e163-175.
4. Nayak HK, Pattnaik B, Patra S, et al. Pancreatic Castleman's disease: Ring of fire sign and endoscopic ultrasonography guided fine-needle biopsy helps preoperative diagnosis[J]. Pancreatology, 2022,22(3):443-445.
5. Zhou K, Urquhart E, Hui C. The white tree: arborising calcification indicating Castleman disease[J]. Abdom Radiol (NY), 2022,47(3):1202-1204
6. Lv K, Zhao Y, Xu W, et al. Ultrasound and radiological features of abdominal unicentric castleman's disease: A case series study[J]. Medicine (Baltimore), 2020,99(18):e20102.
7. Yin Y, Yu T, Mulmi Shrestha S. Unicentric Castleman's disease of hepatic hilum and retroperitoneum: a case report for endoscopic ultrasonography differential diagnosis and a literature review[J]. Clin J Gastroenterol, 2021,14(4):1250-1254
8. Gou H, Fan J, Luo M, et al. Castleman Disease Misdiagnosed as Pancreatic Neuroendocrine Tumor by Fine Needle Aspiration Biopsy[J]. Am Surg, 2023,89(6):2979-2981.
9. Bonekamp D, Horton KM, Hruban RH, Fishman EK. Castleman disease: the great mimic. Radiographics. 2011;31(6):1793-1807.
10. Khashab MA, Canto MI, Singh VK, et al. A rare case of peripancreatic Castleman's disease diagnosed preoperatively by endoscopic ultrasound-guided fine needle aspiration. Endoscopy. 2011;43 Suppl 2 UCTN:E128-E130. doi:10.1055/s-0030-1256163
11. Panagiotakopoulos D, Mouchtouris A, Zarakostas M, Rontogianni D, Athanasiadou P. Endosonographic features of unicentric Castleman Disease. Endosc Ultrasound. 2014;3(Suppl 1):S10-S11.
12. Pitot MA, Tahboub Amawi AD, Alexander LF, et al. Imaging of Castleman Disease. Radiographics. 2023;43(8):e220210. doi:10.1148/rg.220210