程桂莲 吴伟 徐丽明 胡端敏
苏州大学附属第二医院 消化科
腹膜转移癌(Peritoneal Carcinomatosis,PC)又称癌性腹膜炎(图1),临床比较常见,但影像表现复杂多变,容易漏诊误诊。尤其对于原发灶不明的患者,腹膜活检成为后续诊治的关键,但因为腹膜结节通常较小(3-5mm),经体表穿刺困难,很多时候不得不依靠外科手术探查。
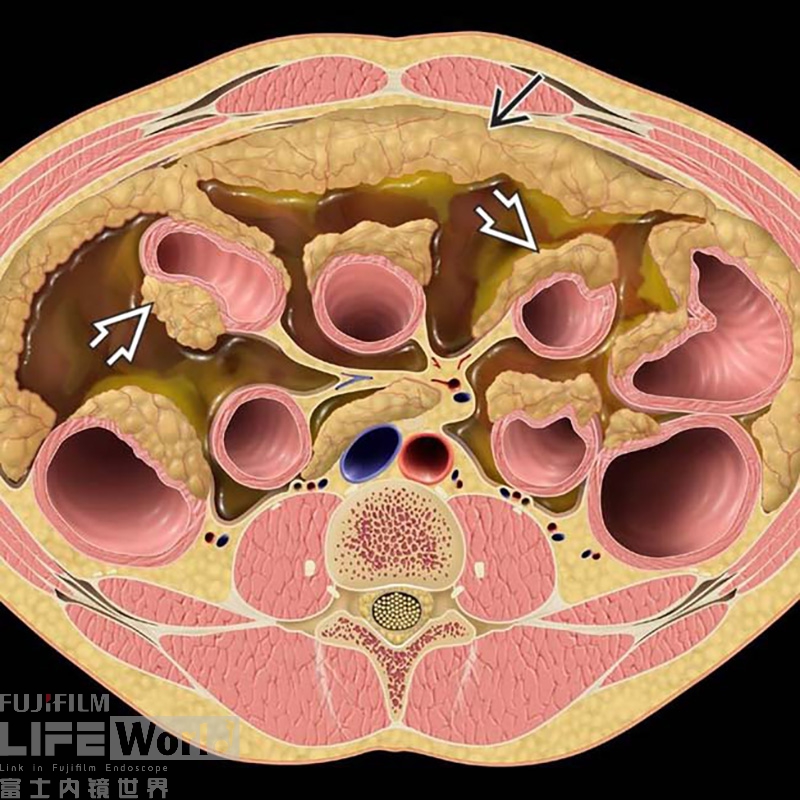
图1 腹膜转移癌示意图(黑箭头大网膜转移;白箭头肠道浆膜侧转移)
随着超声内镜(endoscopic ultrasonography, EUS)的发展,EUS-FNA(endoscopic ultrasound guided fine needle aspiration,EUS FNA)已俨然成为消化道旁实性占位病变的病理获取有效手段。大网膜、肠系膜及盆腔腹膜紧邻消化道,系为超声内镜穿刺针可探及之处,本期与大家分享几例我中心开展的分别经胃、十二指肠及直肠三个站点对相应腹膜行EUS-FNA的应用病例:
病例一:老年女性,10年前有子宫内膜癌手术史,此次因腹部不适行CT检查提示腹膜、网膜多发结节灶,腹腔及腹膜后多发肿大淋巴结,考虑转移癌,请结合病史。为进一步确诊,拟行EUS-FNA(图2及视频1)
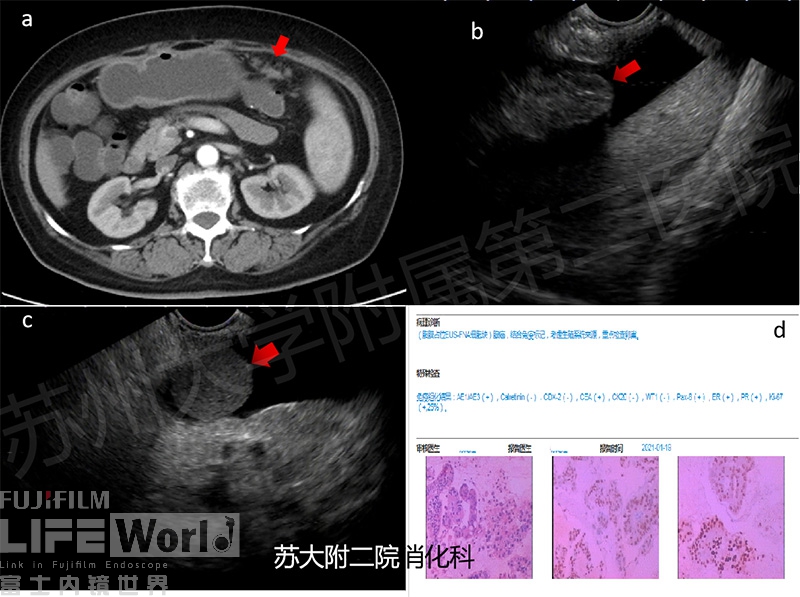
图2:经胃壁穿刺腹膜,红色箭头所指为异常腹膜
视频1
病例二:老年男性,既往有“胰腺炎、胆石症”病史,此次因左上腹痛2周入院,肿瘤指标ProGRP胃泌素释放肽前体 68.92pg/ml,其余阴性。生化、T-SPOT、自身抗体等均阴性。CT提示:腹腔肠系膜血管周围多发占位,脉管源性肿瘤/炎症?神经源性肿瘤?淋巴瘤?结合临床。拟行EUS-FNA术,术中可见肠系膜上动脉周边见多发低回声病变,FNA病理未见肿瘤细胞,无法诊断。随后腹腔镜活检证实丛状神经纤维瘤(图3及视频2)
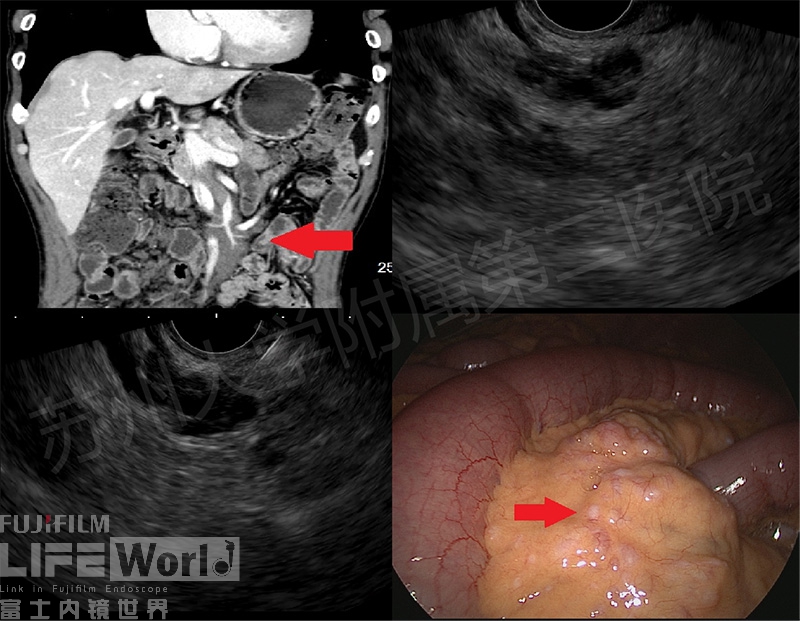
图3 A:CT后发现肠系膜血管周围多发占位,肠系膜血管变窄(红箭头) B-C:EUS显示多发结节包绕肠系膜血管及分支生长 D:腹腔镜下见小肠系膜散在分布黄白色结节(红箭头)
视频2
病例三:老年女性,既往体健,此次因腹痛一周入院,CT及MRI提示直肠子宫凹腹膜及大网膜增厚,考虑恶性病变伴广泛转移。胃肠镜未见异常。拟行经直肠穿刺直肠子宫凹腹膜,EUS提示直肠子宫隐窝区腹膜明显增厚,呈结节状,另见腹腔积液,分别穿刺腹水及腹膜结节送检,病理证实腹水脱落细胞及腹膜活检均见腺癌。(图4及视频3)
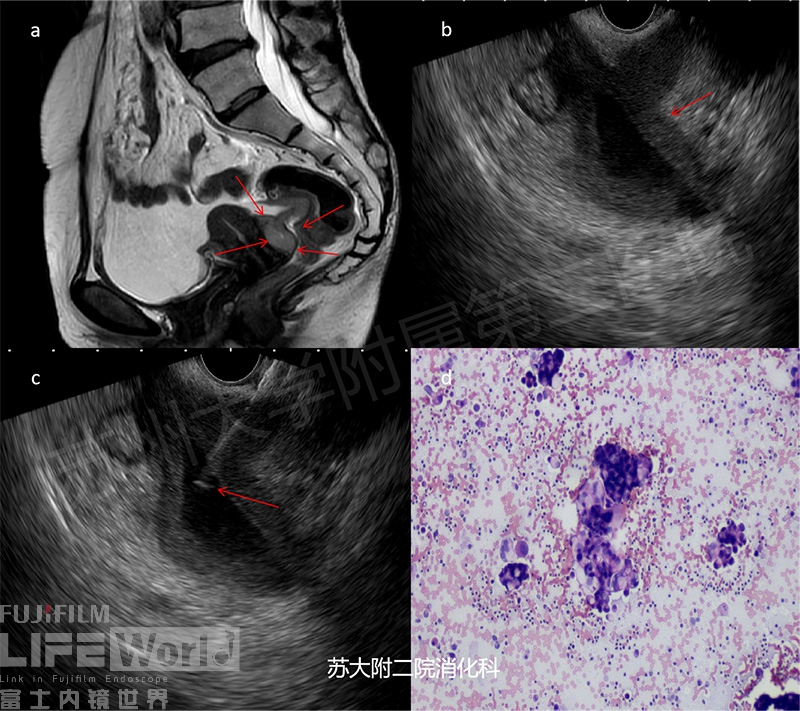
图4:经直肠穿刺直肠子宫凹腹膜及腹水(右下图为腹水脱落细胞见腺癌细胞)
视频3
自此,我中心开展相关病例共19例,其中EUS腹水检出率16例,10例同步行EUS引导下腹腔积液穿刺术(EUS-Paracentesis,EUS-P),5例腹水脱落细胞发现腺癌;19例完成腹膜活检,1例FNA病理不足以组织诊断,其余均确诊为腹膜转移癌(见表1)

表1
PC在影像学上主要表现为腹膜或大网膜增厚或结节样实性肿块,约1/3的PC患者合并存在腹水。大量腹水存在时,经皮腹腔穿刺腹水寻找脱落细胞成为该病诊断的简便有效方法,然诊断阳性率不高。Lee和Kaushik等人提出EUS-P在恶性腹水中具有一定的诊断价值,但EUS-P阴性并不能排除外腹膜转移癌。结核性又或是其他炎症所致的腹膜炎,影像学下表现类似于PC,因此,组织病理成为腹膜疾病的确诊手段。腹腔镜的诊断价值高,但由于可引起种植转移及相关并发症限制了广泛应用。随后陆续有文献报道,腹膜活检可大大提高PC的诊断率。本中心19例患者中,腹膜活检阳性率明显高于腹水阳性率,这与既往文献报道一致。
根据既往病例经验,笔者提出EUS-FNA在腹膜转移癌中的应用主要存在以下难点及注意事项。
一:EUS下如何寻找腹膜病变
腹膜分为脏层腹膜和壁层腹膜,其中腹膜折叠或双层区域称为大网膜或肠系膜,用于支持腹部脏器。脏层腹膜通常位于腹部器官表面,如肠道、肝脏及胃窦周围,位置相对固定,与周边器官有一定的界限;壁层腹膜位于腹壁内侧,如腹壁前壁、两侧壁及盆腔底部(图5),根据腹膜的分布特点,在胃、十二指肠及直肠可追寻其分布方式进行有目标性的探查相应区域腹膜。
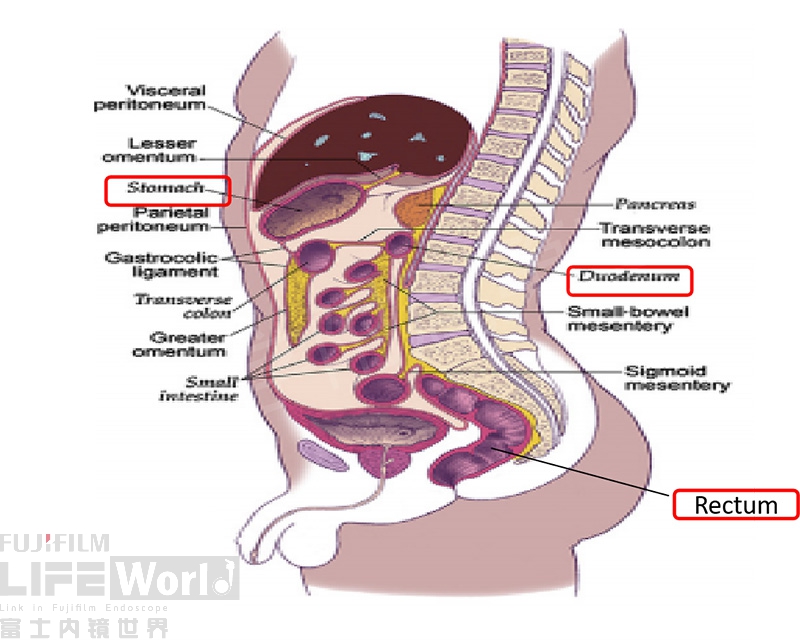
图5腹膜矢状位示意图(空色框为三站穿刺点)
二:EUS下如何鉴别良恶性腹膜结节
正常情况下,腹膜在超声下表现为等高回声,很难辨别出腹膜的边界。但在腹水的衬托下便可清晰可见。然而腹水的存在,腹膜漂浮在腹水中从而又增加了腹膜活检的难度。此时,如何识别出良恶性腹膜,从而进行有目的的活检成为诊断的关键。通过学习文献及总结经验,发现良性结节边界不清,与周围结构回声几乎一致,呈等高回声变化,而恶性结节通常是不连续的低回声肿块或结节(图6)。最近也有学者提出CH-EUS( Contrast-enhanced EUS)根据病变造影谐波增强模式可更好的预测良恶性腹膜。
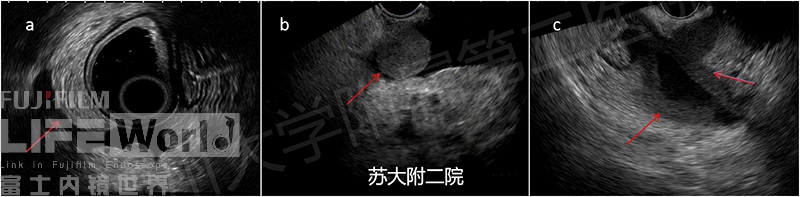
图6: a为良性腹膜;b、c为恶性腹膜
三:如何经直肠进行盆腔腹膜病灶FNA
盆腔直肠外结构为泌尿或生殖器官,非消化科医生所涉及领域,又因平时工作中我们常用的CT或磁共振为横断面结构。因此,由于对盆腔直肠外结构及成像的理解受限,经直肠超声内镜多为环扫超声内镜,且常应用于直肠肿块的分期及直肠粘膜下病灶性质的判定。在超声下,恶性病变多为低回声病变,而卵巢及精囊腺均为表现低回声类圆形结构,与盆腔异常病变极易混淆,而此时如将卵巢或精囊腺误以为恶性病变进行穿刺,将会造成医患双方严重不良后果。由于经直肠腹膜穿刺报道国内外文献不多,笔者通过本中心穿刺病例总结经验如下:1、反复阅读已有的影像资料,明辨病变与直肠、子宫、前列腺、膀胱等周围器官关系;2、先用环扫超声内镜进行寻找病变,进一步明确病变与直肠及周边脏器相应关系,同时还需确认病变所对应直肠距肛门的距离以便快速定位穿刺镜的大概距离;3、更换穿刺镜,此时切忌看到低回声病灶便当作病变进行穿刺,先反复探查,明辨前列腺、精囊腺等正常结构的所在位置,对所怀疑病变反复确认其与直肠的关系(盆腔腹膜转移癌多位于直肠子宫凹,试图找出直肠子宫凹),明确病灶后同步与矢状位CT/MRI进行确认,在反复确认无误后方可行FNA(图7),接下来,让我们一起来下面的病例。
第一步:仔细研究CT和MRI,明确病变位置:
老年患者,4年前因胃癌行外科根治术,完成化疗后常规随访,但2021年7月CT复查发现直肠、膀胱凹一7mm结节,新发结节在2020年10月CT未显示(图7)。
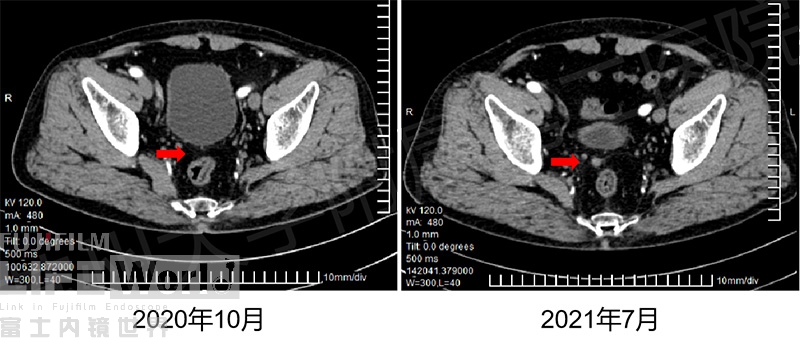
图7 :红色箭头提示腹膜新发结节
第二步:环扫EUS找到病灶,熟悉内部回声特点后换线阵EUS
该病灶大小仅7mm,经体表穿刺困难,故尝试EUS-FNA,首先分析CT影像,明确病灶位于右侧精囊腺上方。接着,利用环扫EUS依据CT找到该结节,此时,熟悉病灶内部回声特点十分重要。(图8)
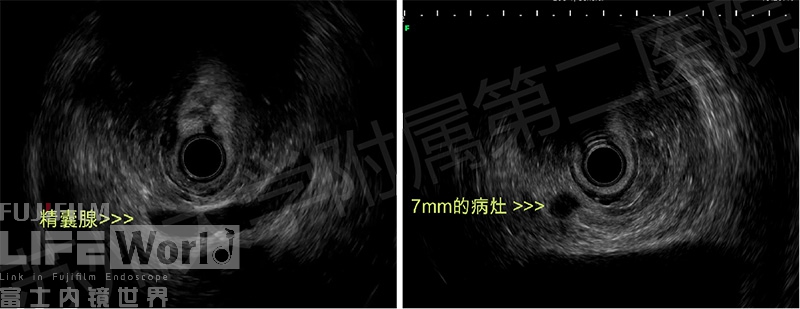
图8 A: 环扫EUS;B:线阵EUS
第三步:更换线阵EUS完成FNA
最后,换线阵EUS探查,根据环扫进镜距离和肠壁位置,以及结节周边解剖和内部回声特点再次定位。此时切忌看到低回声病灶便当作病变进行穿刺,先反复探查,明辨前列腺、精囊腺等正常结构的所在位置,对所怀疑病变反复确认其与直肠的关系(盆腔腹膜转移癌多位于直肠子宫凹,试图找出直肠子宫凹),明确病灶后同步与矢状位CT/MRI进行确认,在反复确认无误后方可行FNA(图9)。
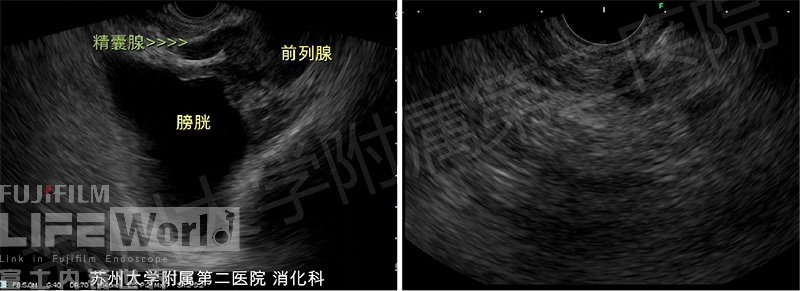
图9:线阵超声探查
该患者最终确认为癌结节,行腹腔镜局部切除,同时置管完成腹腔灌注化疗(图10),目前病情稳定,随访中。(视频4)
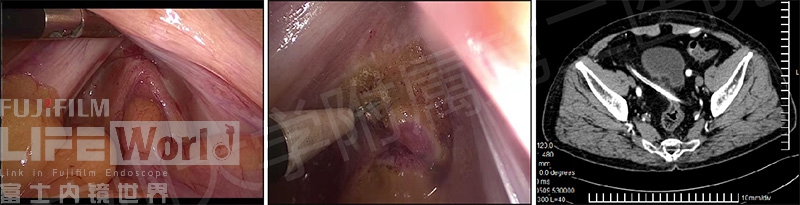
图10 腹腔镜所见及术后置管后CT复查
视频 4
另外,笔者团队发现EUS不仅对腹水敏感性高,而且穿刺抽液的阳性率也很高,即使5-10ml的腹水也能发现富集的肿瘤细胞,似乎远高于腹穿的结果。我们认为原因可能是EUS-FNA穿刺的部分往往是腹腔的低位(比如左侧卧位的脾周或平卧位的盆腔),由于重力作用,腹水及里面肿瘤细胞容易沉积在这些部位的缘故吧(图11-12)。
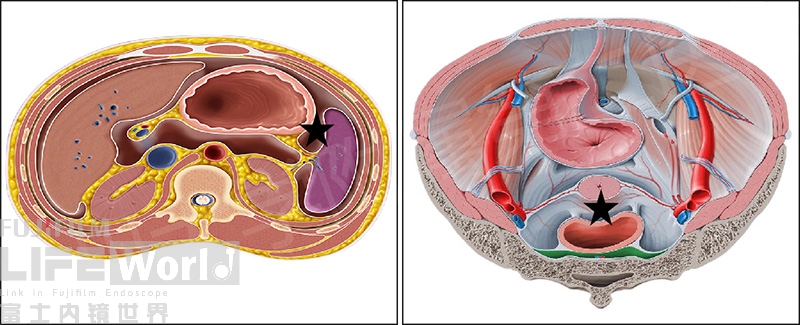
图11 左侧和平卧时的相对低位(星号)
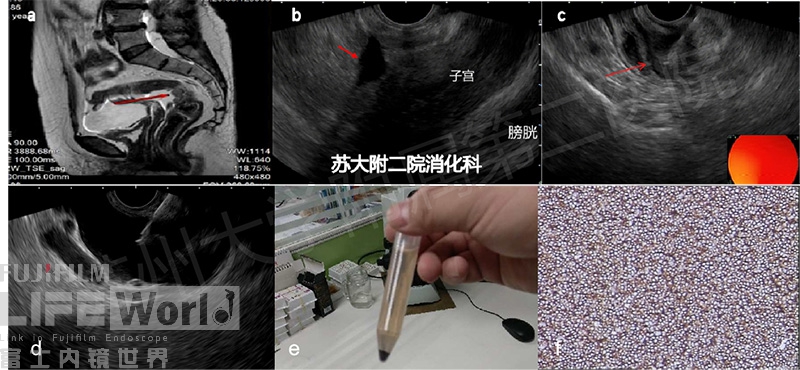
图12:a-c:经直肠穿刺MRI及EUS对照图(b图红色箭头所示直肠子宫凹腹水);d-f:脾周腹水穿刺,离心后可见富集肿瘤细胞,免疫组化证实Burkitt淋巴瘤
PC一旦确诊,意味着疾病处于终末阶段,治疗手段有限,预后极差。随着医学技术的发展,研究发现早期的PC通过腹腔热灌注化疗联合腹膜部分切除减瘤术可明显改善患者预后。因此,如何早期诊断PC,成为这一类患者的治疗关键。然而,由于腹膜的解剖结构复杂,包括腹膜反射、韧带、腹膜间隙,以及大网膜等,早期微小的腹膜结节难以发现。PC的理想成像方式是具有高分辨率以便发现腹膜微小病灶,并能同步进行组织学检查。EUS具有高频探头,能近距离探查消化道周边腹膜,同时实时监测下完成腹膜病变活检,正可以满足以上两个条件。综上所述,EUS-FNA有望成为原发灶不明的PC的临床诊断利器。
1.Lee Y, Ng E, Hung L, et al. Accuracy of endoscopic ultrasonography in diagnosing ascites and predicting peritoneal metastases in gastric cancer patients. Gut 2005;54:1541-1545.
2. Kaushik N, Khalid A, Brody D, et al. EUS-guided paracentesis for the diagnosis of malignant ascites. Gastrointest Endosc. 2006;64:908-913.
3.Surinder Singh Rana, Manish Rohilla , Ravi Kumar Sharma, et al. Contrast-enhanced EUS for evaluation of thickened omentum. Gastrointest Endosc. 2020;9;92(3):783-784
4.Michael J Levy, Barham K Abu Dayyeh, Larissa L Fujii, et al. Detection of peritoneal carcinomatosis by EUS fifine-needle aspiration:impact on staging and resectability (with videos). Gastrointest Endosc. 2015;81(5):1215-1224
5.Vishal Sharma , Surinder Singh Rana , Sobur Uddin Ahmed, et al.: EUS-FNA from ascites and peritoneal nodules. Endoscopic Ultrasound. 2017;6(6):382-388
6.Surinder S. Rana, Deepak K. Bhasin. EUS: a panacea for detection of peritoneal carcinomatosis.Gastrointestinal Endoscopy 2015;5(18):1225-1227