程桂莲 戴彦苗 吴伟 徐丽明 胡端敏
苏州大学附属第二医院: 程桂莲 吴伟 徐丽明 胡端敏
昆山市中医医院:戴彦苗
结核病历史悠久,尽管抗生素和卡介苗的发明有助于其控制。然而,近20年来,由于免疫缺陷疾病的流行以及耐药菌的增加,结核出现了死灰复燃的趋势。虽然肺是结核病的主要靶器官,但它也可以影响其他多个系统---肺外结核。肺外结核临床表现多样、病理获取困难,且影像学特异性不高,常被误诊为普通炎症或恶性肿瘤。消化道及其周边脏器是结核常见受累部位,包括淋巴结、腹膜、胃肠道和其他实质脏器。本期我们将结合工作中的病例和相关文献,与大家分享内镜超声(EUS)在结核病中的应用。
一、肺结核
诊断肺结核需要胸部CT、支气管镜、痰找抗酸杆菌等综合手段,但我们团队今年遇到的一例肺结核患者,EUS-FNA起到举足轻重的作用。这是一位老年男性,否认结核病史,每年行肺部CT体检,但2021和2022年因新冠疫情中断两年,2023年5月份再次CT复查时发现右上肺占位,考虑肺癌(图1)。
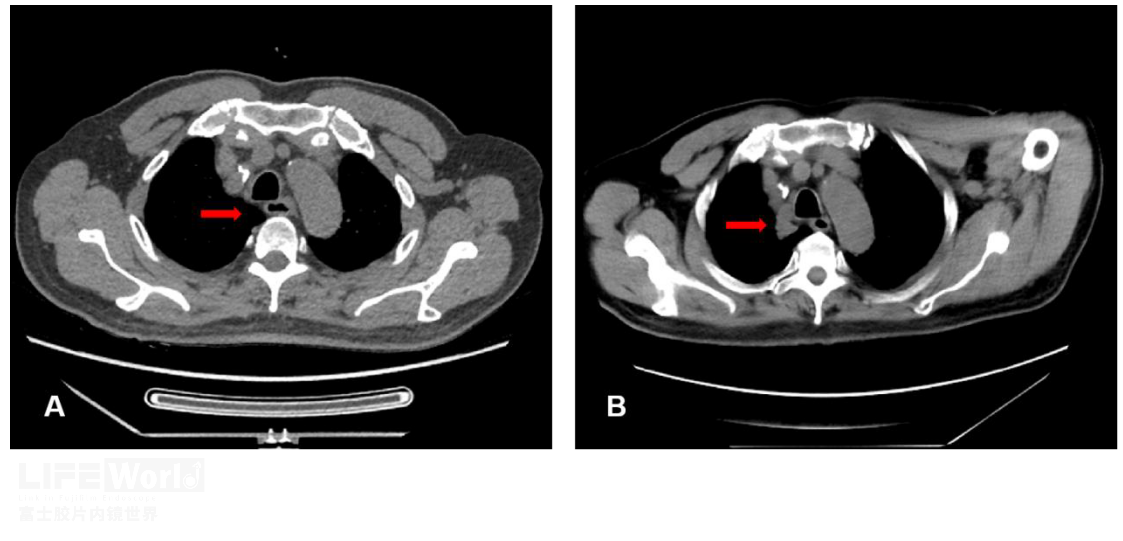
图1 两年CT同一位置对比(红色箭头) A: 2020年10月份 B:2023年5月份
因病灶周边的血管较多,经皮穿刺路径远且病灶紧邻食管,遂采用经食管EUS-FNA获取病理。病灶位于主动脉弓对侧,EUS找到主动脉弓后右旋镜身180度即可发现目标(图2A和2B),实施EUS-FNA时注意避开带有振铃回声的气管,最终病理为肉芽肿炎(图2C),临床考虑肺结核。
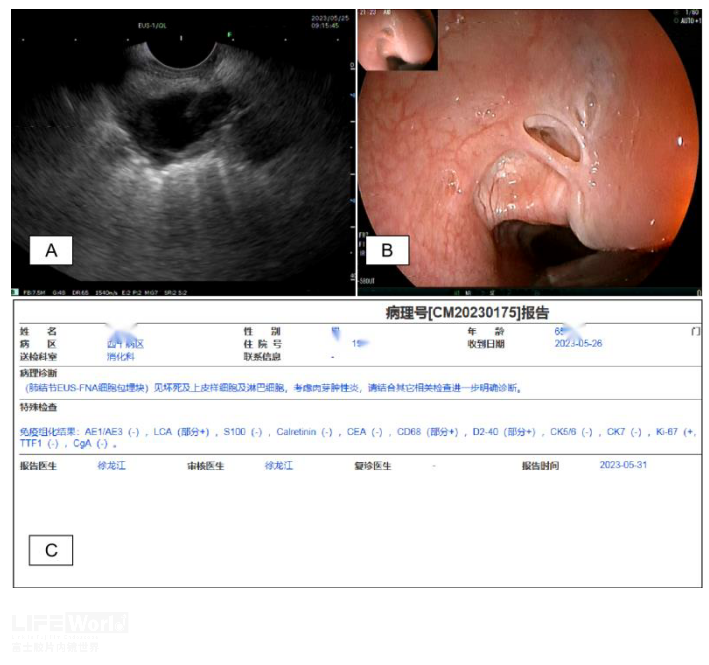
图2 超声内镜检查 A: EUS下的病灶 B:食管前壁陈旧性疤痕 C: EUS-FNA病理结果
患者接受标准抗痨治疗两月后复查,肺部病灶明显缩小(图3)。
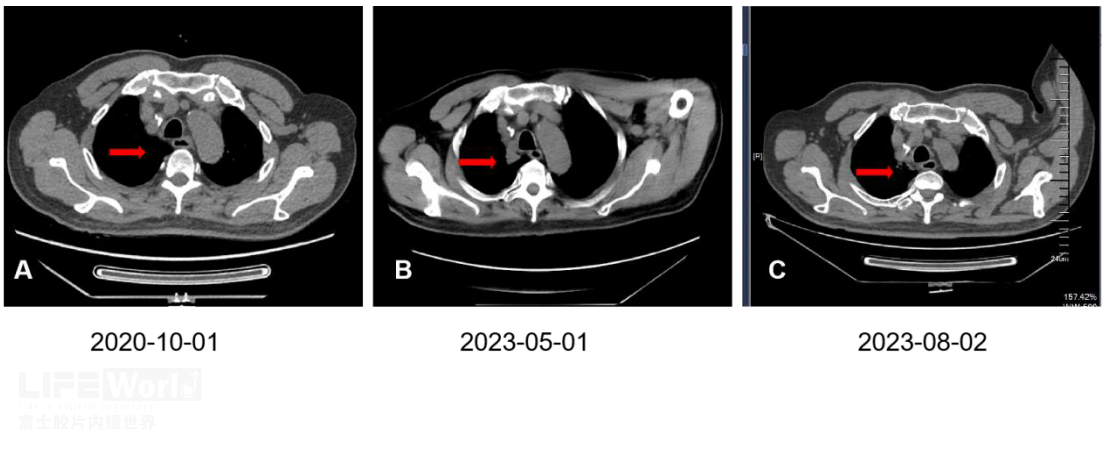
图3:抗痨治疗后复查病灶明显缩小(红箭头)
二、淋巴结结核
淋巴结核影像特点为数量增多、体积增大、或融合成簇,典型者可见中央液化伴外周强化,愈合期可伴有钙化及纤维化。淋巴结核需与转移性淋巴结、淋巴瘤等鉴别,文献报道淋巴结核周围强化明显,而淋巴瘤则为均匀强化。淋巴瘤更容易影响主动脉旁淋巴结且通常比结核性淋巴结大。而当患者有原发性恶性肿瘤时,诊断更倾向于转移性淋巴结。
淋巴结核的超声内镜表现可以包括以下几个方面:(1)淋巴结增大:通常呈现为局部淋巴结非对称性增大。增大的淋巴结形态不规则,轮廓模糊。(2)淋巴结形态改变:淋巴结核可导致淋巴结形态改变,如淋巴结的椭圆形扁平化、分叶状,以及纵横径比例失调等。(3)淋巴结内回声变化:淋巴结结核的超声内镜检查中,淋巴结内部的回声特征可能发生变化。早期淋巴结结核可能呈低回声或均匀回声,而晚期淋巴结核可呈现为多囊样变化、钙化、内部坏死等。(4)淋巴结边界模糊:淋巴结结核可导致淋巴结与周围组织的边界模糊,使得淋巴结与邻近结构难以区分。(5)血流变化:淋巴结结核通常表现为血流信号减弱或不连续。虽然淋巴结核有以上EUS特点,但与普通炎症、转移瘤及淋巴瘤的差异很小,从回声的高低依次为炎症、转移瘤及淋巴瘤;相对于炎症及转移瘤,淋巴瘤的回声更均匀一致,三者生长方式无显著的不同。因此,虽然EUS可提供有关淋巴结大小、形态、内部回声、边界和血流情况等信息,但最终确诊仍需病理。此时,EUS-FNA具有重要价值。
病例(一):青年男性,既往体健,因腰背酸痛2月入院,CT提示后腹膜恶性肿瘤累及胰腺,伴腹腔及腹膜后淋巴结转移。CA125:206(正常值<35U/ml),T-sport阳性,检测孔斑点数35。拟行EUS-FNA术,术中可见胰腺轮廓正常,胰头与肝门间团块状低回声病灶,腹腔多发肿大淋巴结,穿刺病理:见多发淋巴细胞伴大量坏死,结核待排。同步完善磁共振,MRI提示腹膜后、腹腔多发肿大淋巴结伴环形强化,考虑结核可能性大。因诊断不明,拟行腹腔镜活检,术中见腹腔多发粟粒样结节,于大网膜活检,诊断多发肉芽肿性炎伴少量坏死,考虑结核(图4)。
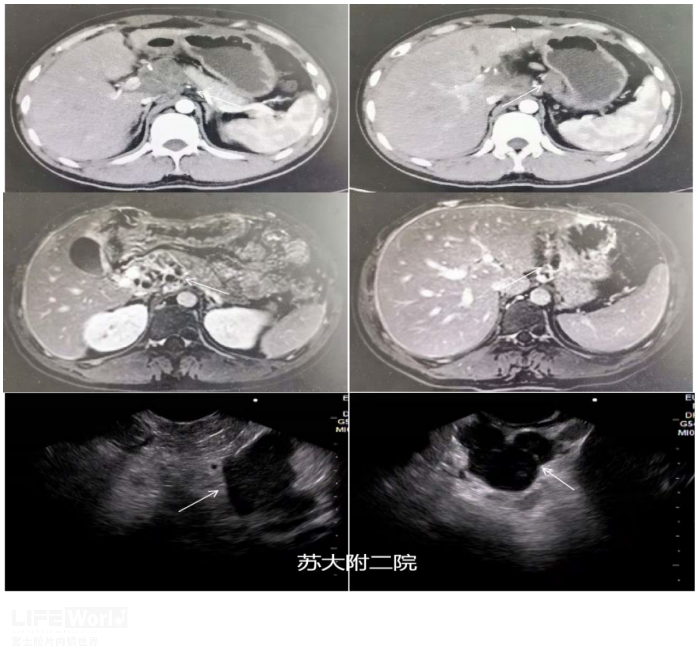
图4:CT及MRI见胰头区域及肝胃区域多发异常回声病灶;EUS显示胰腺边界清晰,融合淋巴结位于胰头上方,呈低回声改变
病例(二):青年女性,体检发现腹腔肝胃间隙结节灶7月入院,外院CT提示腹腔孤立肿大淋巴结,长径约20mm,边界清晰,EUS显示肝胃间隙低回声淋巴结,淋巴门消失,内部见无回声坏死区域,EUS穿刺出乳黄色粘稠物质及少量组织条,送检病理未见肿瘤细胞,抗酸杆菌涂片阳性(图5,视频1),考虑淋巴结核。予抗结核治疗12月后病灶消失(图6)。
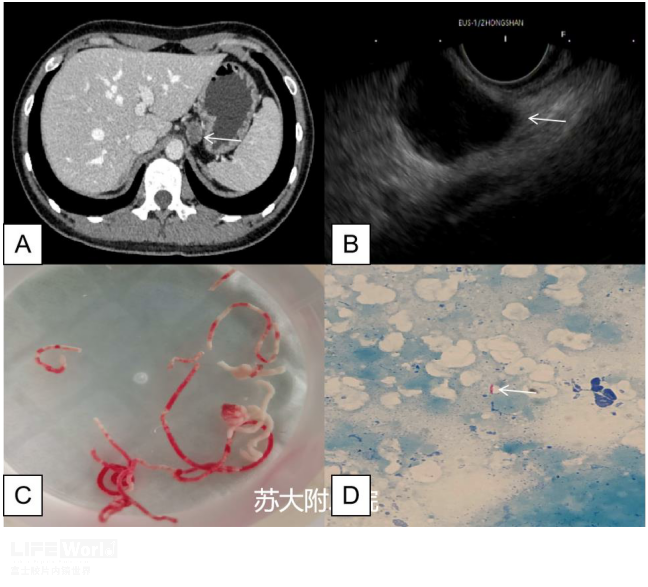
图5:淋巴结核 A:CT可见肝胃间隙肿大淋巴结;B:EUS显示肿大淋巴结,淋巴门消失;C:FNA可见乳黄色物质及少量血性组织;D:抗酸杆菌涂片阳性(白色箭头)
视频 1
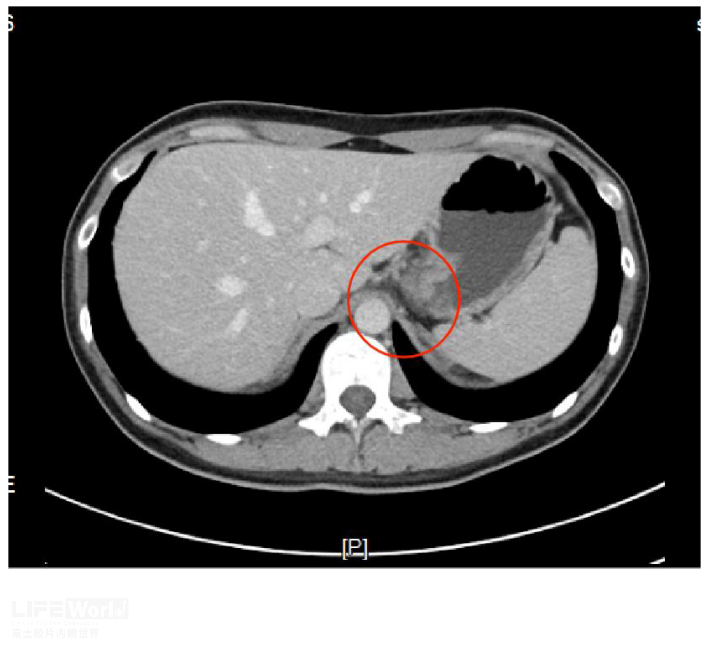
图6 抗痨治疗一年后淋巴结肿大消失
病例(三):男性,既往有结核病史,MRI+MRCP发现肝门多发软组织影,病灶外压致胆总管下段变细(图7A)。EUS发现十二指肠球部溃疡(图7B),超声探查见肝门处多个融合淋巴结,内部高回声钙化(图 7C),融合淋巴结与球部溃疡病灶连续(图7C 视频 2)。结合既往病史和典型EUS表现,予正规抗结核治疗,复查EUS时发现球部溃疡愈合(图7D),肝门淋巴结明显缩小,胆总管扩张改善。
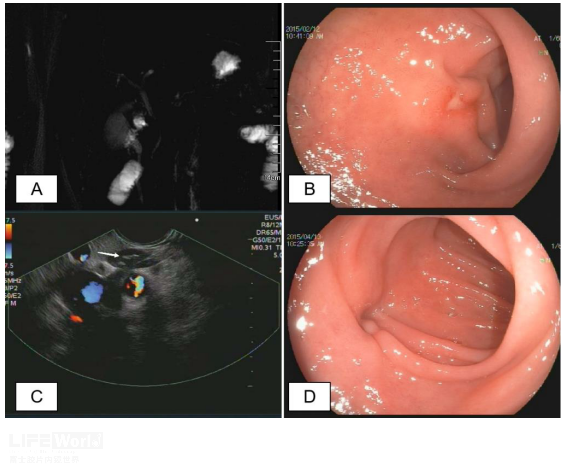
图7 肝门淋巴结结核 A: MRCP示胆总管下端受压;B: 十二指肠球部见溃疡;C: 肝门部淋巴结(箭头:内部高回声);D:抗痨治疗后球部疤痕
三、腹腔实质脏器结核
腹腔实质脏器(如胰、肝、脾)结核的影像学特点因不同发展阶段而表现各异,可表现为孤立的肿块或弥漫性实质脏器肿大,常常和原发肿瘤、继发性转移及淋巴瘤等难以鉴别。也常误诊为恶性肿瘤而手术。
(一)胰腺结核
胰腺结核临床罕见,占全身结核不足5%,常继发于其他部位的结核。胰腺结核好发年龄为36~56岁,男性为主,多无特异性的临床表现。2016年的一项系统回顾发现,以腹痛、食欲减退/体重减轻居多,其他表现包括:发热、盗汗、黄疸、腹部肿块和周围淋巴结肿大等。据文献报道,胰腺结核主要累及胰头,可能与胰头周围血运、淋巴结及淋巴管丰富相关,病灶可单发或多发,弥漫性罕见。病灶可表现为实性、囊实性、囊性等多种特征,影像学上很难和胰腺肿瘤性病变相鉴别。近年来超声内镜在胰腺结核诊断中的应用越来越受到重视,既往认为常规EUS的声像与胰腺肿瘤无显著差别,但随着超声造影、弹性成像等新技术的发展,一些征象可能有助于鉴别,笔者总结如下:1.不伴有胆管扩张。由于胰腺结核好发部位在胰头部,需要与此处的胰腺癌相鉴别,不同于胰腺癌多合并胆道扩张,文献报道的胰腺结核很少有胆管扩张表现。2.超声造影:胰腺结核的超声造影呈现高增强的表现,与典型胰腺癌的低增强不同。3.弹性成像:胰腺结核病灶的硬度相比正常胰腺组织高,类似于自身免疫性胰腺炎的表现。但需要注意的是,以上两种超声新技术的病例较少,是否有普适性需要进一步的积累。除了对病灶的超声观察以外,超声内镜还能通过FNA/B来获取病理,观察是否存在肉芽肿,以及进一步进行PCR、培养等检测来明确诊断。通过术前的病理诊断,可以避免部分患者接受不必要的手术治疗,有报道,FNA的诊断阳性率可达76%。接下来介绍下本中心通过FNA诊断的一例胰腺结核。
病例一:患者48岁男性,因“腹痛1月余”入院,近期体重减轻约5kg。肿瘤指标、肝肾功能正常。腹部CT及MRI提示:胰头部占位累及肝脏、后腹膜淋巴结可能,IPMN恶变可能(图8A)。EUS显示胰头部见一2.6× 2.9cm不规则低回声区,内部回声混杂,局部可见低回声及高回声区(图8B-C),左肝见一6×5cm混杂回声病灶,内部呈现大片高回声影,左肝病灶与胰头部病灶相连续,胆胰管未见扩张,胰腺后方可见低回声淋巴结影,大小约2.5×1.4cm。对胰腺病灶进行穿刺后病理可见大片干酪样肉芽肿性坏死,坏死灶周围可见上皮样细胞和郎罕斯多核巨细胞及淋巴细胞浸润(图8 D-E)。行结核PCR后CT值为28.2(正常>37)。考虑胰腺结核,专科医院给予抗结核治疗后半年复查影像学提示胰腺及肝脏病灶明显缩小(图8F)。
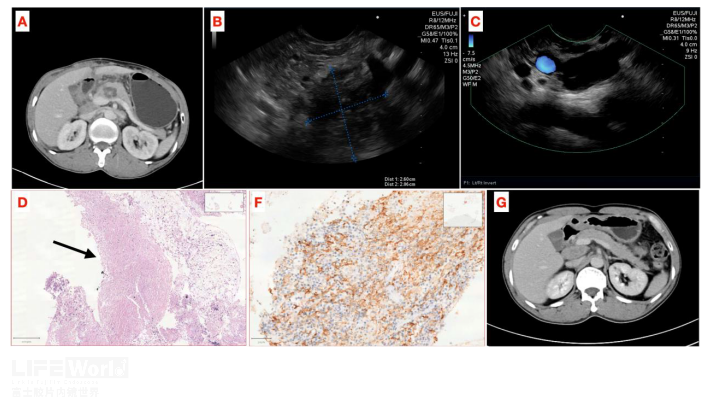
图8:胰腺结核(A:CT可见胰头部低密度病灶,胰管无扩张;B:EUS下胰头部低回声病灶,内部回声不均匀,散在高回声;C:胰体后方可见不规则低回声淋巴结。D:穿刺组织条内见大片干酪样坏死区,箭头。F:CD163染色提示大量巨噬细胞;G:抗结核治疗半年后复查,胰腺病灶明显缩小。
病例二:来源于文献报道,CT见胰头低密度灶,内镜下十二指肠球部见外压性改变,表面见溃疡形成,超声下见低回声病灶,考虑胰腺癌,予Whipple手术,术后大体病理可见由淋巴细胞、上皮样细胞和多核巨细胞组成的肉芽肿状结节。
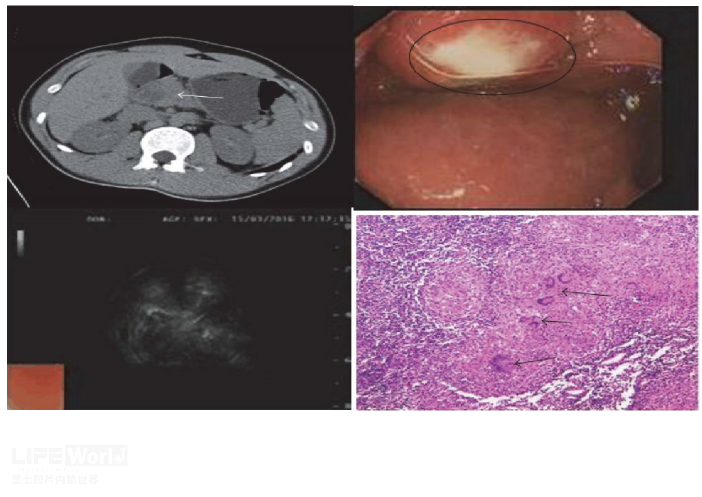
图 9 胰腺结核
图片来自文章Pancreatic Tuberculosis with Vascular Involvement and Peritoneal Dissemination in a Young Man. Digestive and Liver Disease. 2003,4(35): 283-287)
(二)脾脏结核
脾脏结核罕见,通常由肺部或其他器官的结核病灶经血液循环而累及脾脏。脾脏结核的EUS表现包括:脾脏增大,伴低回声或混合回声结节(图 10)。需要注意的是,脾脏结核的超声内镜表现并非特异,可能与其他疾病如淋巴瘤等相似。因此,在诊断过程中,还需要综合考虑患者的临床症状、实验室检查和其他影像学结果来进行鉴别诊断。最终的确诊通常需要组织活检。陈旧性脾脏结核在影像学检查中可能呈现为脾脏体积缩小、纹理不清晰或稀疏、脾实质的萎缩等。此外,可能存在钙化病灶或瘢痕组织。
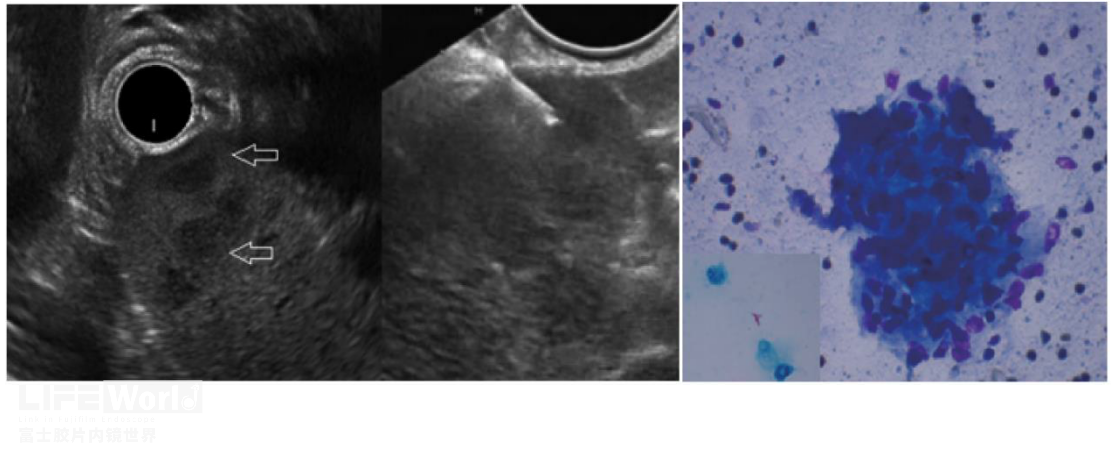
图10 脾脏结核(左、中图:EUS及FNA;右图病理可见上皮样细胞肉芽肿,插图可见抗酸杆菌.图片来自文章Splenic Tuberculosis Diagnosed by Endoscopic Ultrasound-Guided Fine Needle Aspiration. Endoscopic Ultrasound. 2012,9(18):167-168)
笔者团队曾遇到一青年男性患者,曾有多脏器结核病史,经治疗后痊愈,常规探查时发现脾脏弥漫性钙化,结合病史考虑陈旧性脾结核(图11,视频2)。
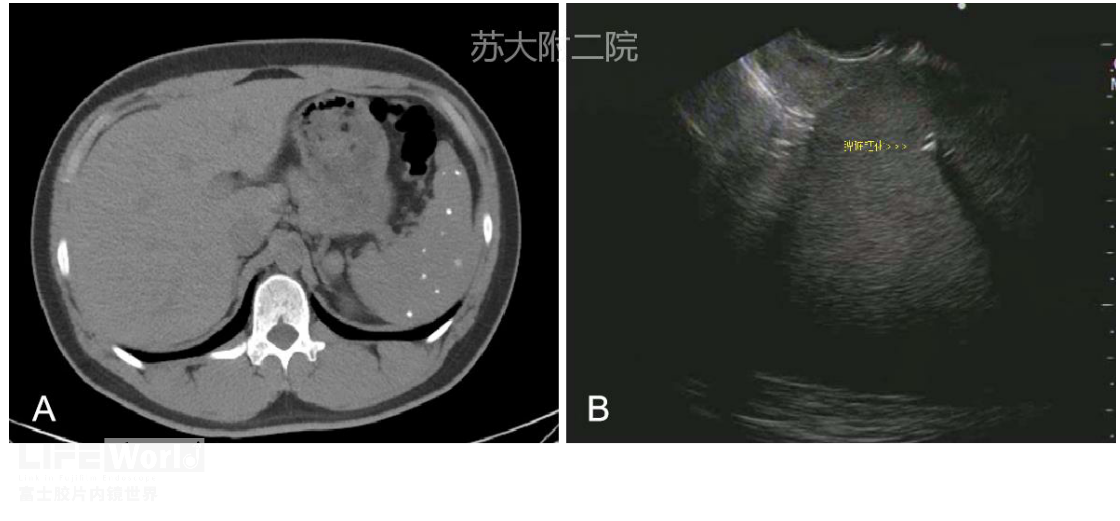
图11 脾陈旧性结核(多发钙化) A CT ;B 超声内镜
视频2
四、消化道结核
由于回盲部的淋巴组织丰富和肠道内容物的相对停滞而易感染,故80-90%的消化道结核位于回盲部,其他受累部位按频率降序依次为结肠、小肠、十二指肠、肛门、食管和胃。肠结核在内镜下有特征性的改变,本期不再赘述。
(一)食管结核
由于上消化道胃酸及食管的廓清作用,结核很难定植故非常少见。食管结核多发生在食管中段,因为它靠近肺门和气管分叉周围的纵隔淋巴结。常见的临床表现为胸骨后疼痛或不适,或(和)吞咽困难,无典型的结核中毒症状。胃镜下可见粘膜或粘膜下隆起病变、溃疡、憩室和瘘管形成。据文献报道,食管结核具有以下特征性EUS改变:(1)食管壁增厚,结构不清,部分食管外膜中断;(2)食管壁内低回声病变,边界不规则,内回声不均匀,或散在的高回声钙化;(3)食管旁或纵隔旁肿大淋巴结内见部分散在钙化;(4)食管壁病变与肿大的食管旁淋巴结相连。其中最后一点最具有特征性意义,也正是食管旁淋巴结核累及食管所致的声像学变化。接下来介绍下本中心确诊的两例表现为黏膜下隆起食管结核。
病例一:青年男性,因胸骨后疼痛伴进食哽噎感半年左右就诊,CT提示:中纵隔占位,压迫临近食管,考虑肿大淋巴结可能。拟行EUS-FNA检查,术中胃镜提示食管距门齿28-32cm见食管隆起改变,表面光滑,微探头超声显示局部食管壁正常结构破坏,层次中断,见
混杂回声,病灶与纵隔淋巴结相连,考虑结核。随后拟行FNA,穿刺标本未见肿瘤细胞,见散在淋巴细胞。同步完善结核T-Sport阳性,斑点数>100。予抗结核治疗4月后复查CT,病灶基本消失(图12)。
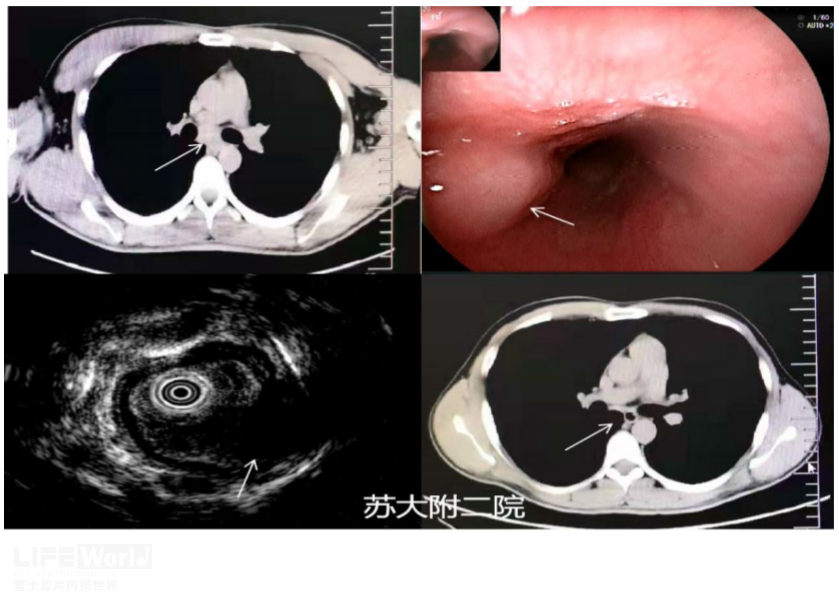
图12 食管结核 A:CT示左右主支气管间占位 B: 内镜下黏膜光滑 C: 微探头超声内镜声像;D:4月抗结核后同一层面病灶消失
病例二:青年男性,胸骨后痛入院,CT提示后纵隔占位,胃镜提示据门齿29cm见食管隆起,表面光滑,EUS显示病灶与食管分界不清,术后病理提示肉芽肿性炎性坏死,考虑结核。(图13)。
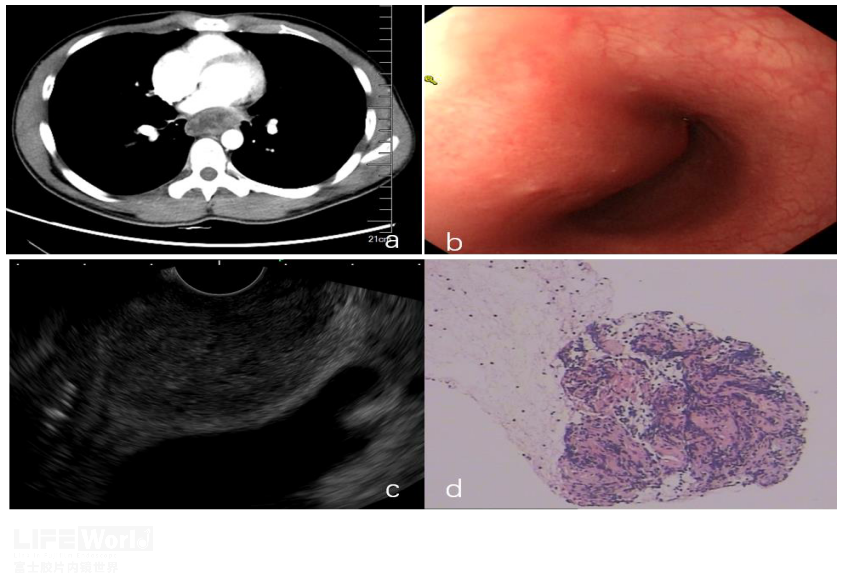
图13 继发食管结核
A:食管及心脏间占位;B: 内镜下黏膜光滑;C: 线阵EUS所见;D:穿刺病理
食管结核最具特征的EUS改变为食管壁外膜中断,病变与食管外淋巴结相连,而这一特征性改变在线阵超声下难以体现,故笔者建议:如临床考虑食管结核,建议先予微探头或环扫超声内镜进行探查,这样可以更好的展示横断面层次关系。尽管EUS-FNA无法保证每次能提供非干酪样坏死或抗酸杆菌涂片阳性证据,但基于其特征性的EUS声像改变,结合临床表现,可考虑诊断性抗结核治疗。
(二)胃结核
由于胃酸的存在,胃排空迅速,胃壁淋巴组织的缺乏,使得其免受结核的侵袭。但在卫生条件极差区域又或是免疫缺陷患者中,胃结核的发病率明显提高,常见于胃窦区域,镜下多表现为溃疡性病灶。然孤立的以黏膜下隆起为表现,超声内镜下类似于胃间质瘤的胃结核亦有报道(如图14)
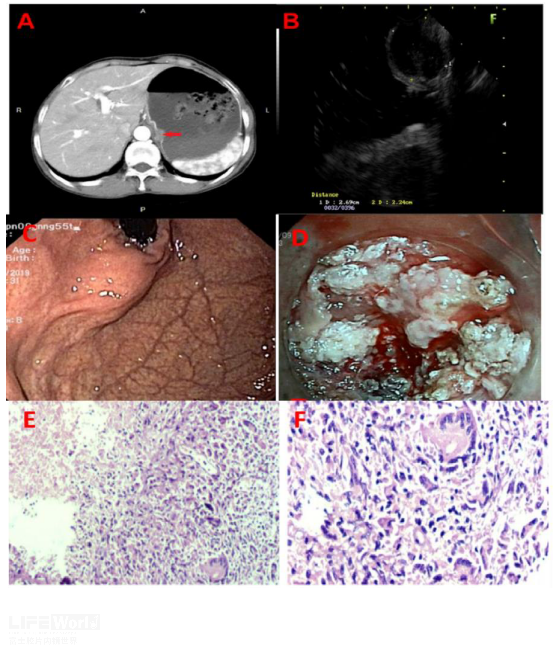
图14 胃结核
A: CT增强显示贲门小弯侧见软组织肿块(红色箭头);B: EUS检查显示低回声病变,起源于第四层,内部回声不均匀,边界清晰;C: 内镜下病灶表面光滑;D: ESD时见病变起源于第四层,充满乳白色液体和白色肉芽组织;E-F:病理示干酪样坏死、朗汉斯巨细胞和肉芽肿性炎症。
图片来自文章Primary isolated asymptomatic gastric tuberculosis of the cardia mimicking gastric stromal tumor: a rare case report and literature review. BMC Gastroenterology. 2020,20(108):2-4.)
五、结核性腹膜炎
结核性腹膜炎常表现为腹膜异常改变伴或不伴腹腔积液,当伴有腹腔大量积液时,根据腹水性质同时结合临床表现,基本可形成临床诊断。然而,仅表现为腹膜点状、结节状或块状增厚,此时腹膜病理的获取成为诊治关键,特别在一些抵抗力低下或合并症较多的患者中,诊断更为棘手。2015年,Levy等人报道了EUS引导下腹膜和网膜活检是安全及可靠的技术,随后陆续有报道EUS-FNA在腹膜疾病中的诊断价值。Ravi等人报道了EUS引导下的腹膜FNA是诊断腹膜结核的良好方法,特别是在失代偿性肝硬化的情况下,当腹膜结核的症状、体征和实验室特征被肝病导致的腹水所掩盖时,EUS-FNA可以更安全、更多的获取腹膜组织从而达到确诊(图15)。
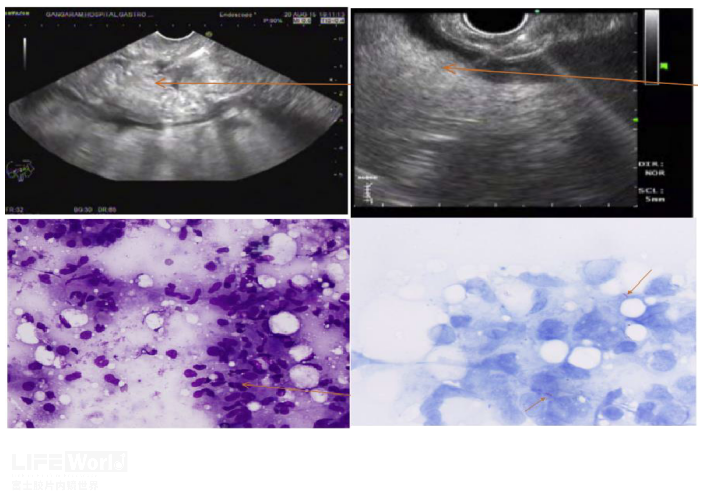
图15(EUS可见腹膜增厚及微量腹水;Giemsa染色涂片显示肉芽肿伴上皮细胞样细胞;抗酸杆菌涂片阳性。
图片来自文章Endoscopic Ultrasound (EUS) Guided Fine Needle Aspiration: A New Modality to Diagnose Peritoneal Tuberculosis in Presence of Decompensated Cirrhosis-A Case Series and Review of Literature. Journal of Clinical and Experimental Hepatology .2018,8 (2):1-5)
结核病,不仅仅是经年不绝的白色瘟疫,也是医学界的“拟态”高手,因其所累及的脏器和发展阶段不同,影像学表现各异,常被误诊为肿瘤从而导致不必要的手术。尽管单纯EUS声像学无法辨别出结核病,但当临床面临一些易感人群时,对EUS-FNA标本处理及结果判读成为诊治的关键。结合文献及本中心经验,笔者建议标本的送检不应局限于常规涂片及病理,还需送检抗酸杆菌涂片,同步送检组织TB-DNA及X-pert很有帮助。由于我们单位所在地为非结核好发区域,所遇病例不多,经验有限,请各位同道批评指正。
参考文献
1.Levy MJ, Abu Dayyeh BK, Fujii LL, et al. Detection of peritoneal carcinomatosis by EUS fine-needle aspiration: impact on staging and resectability (with videos). Gastrointest Endosc 2015,81(12):15-24.
2.Ravi Daswani , Ashish Kumar , Vikas Singla, et al. Endoscopic Ultrasound (EUS) Guided Fine Needle Aspiration: A New Modality to Diagnose Peritoneal Tuberculosis in Presence of Decompensated Cirrhosis-A Case Series and Review of Literature. Journal of Clinical and Experimental Hepatology. 2018,8(2):1-5.
3.Mingnan Lv, Kejiang Tang, Yajie Meng, et al. Primary isolated asymptomatic gastric tuberculosis of the cardia mimicking gastric stromal tumor: a rare case report and literature review. BMC Gastroenterology. 2020,20:(108):2-4.
4.Surinder Singh Rana, Deepak Kumar Bhasin, Chalapathi Rao, et al. Splenic Tuberculosis Diagnosed by Endoscopic Ultrasound-Guided Fine Needle Aspiration. Endoscopic Ultrasound. 2012,9(18):167-168.
5.Meng Zhu, Ning Zhang, Wei Tao, et al. Pancreatic Tuberculosis with Vascular Involvement and Peritoneal Dissemination in a Young Man. Digestive and Liver Disease. 2003,33(4) 283-287.
6.Pankaj Gupta, Suresh Kumar, Vishal Sharma, et al. Common and uncommon imaging features of abdominal tuberculosis. Journal of Medical Imaging and Radiation Oncology. 2019. doi:10.1111/1754-9485.12874.
7.Duangkamon Prapruttam, Sandeep Hedgire, Sunithi Elizabeth Mani, et al. Tuberculosis-The great mimicker. Seminars in Ultrasound, CT and MRI. 2014, 3(35):195-214.
8.Sharma, V, Rana, SS, Kumar, A, et al. Pancreatic tuberculosis. J GASTROEN HEPATOL. 2016; 31 (2): 310-8.
9.Dong, Y, Jürgensen, C, Puri, R, et al. Ultrasound imaging features of isolated pancreatic tuberculosis. ENDOSC ULTRASOUND. 2018; 7 (2): 119-127.
10.Maulahela, H, Fauzi, A, Renaldi, K, et al. Current role of endoscopic ultrasound for gastrointestinal and abdominal tuberculosis. JGH Open. 2022; 6 (11): 745-753.