顾夏贤、吴伟、程桂莲、徐丽明、胡端敏
苏州大学附属第二医院 消化科
多原发恶性肿瘤(MPMN)是指在患者不同器官同时或先后发生两种或以上的原发恶性肿瘤,临床上易被误诊为肿瘤复发或转移[5]。对于多原发癌的诊断,必须符合以下的标准:(A)每个肿瘤都被病理证实为恶性肿瘤;(B)每个肿瘤必须在解剖学上独立定位;(C)每个肿瘤都必须被排除为其他肿瘤转移。随着诊断技术和预期寿命的不断提高,MPM 发病有增多趋势。据文献报道,结直肠癌、乳腺癌和头颈部癌是最常见的第一原发癌,肺癌、乳腺癌和结直肠癌是最常见的第二原发恶性肿瘤。而最常见的双原发肿瘤是头颈部癌和肺癌的组合以及乳腺癌和妇科癌的组合。
虽然多原发恶性肿瘤(multiple primary malignant neoplasms,MPMN)在临床工作中越来越多见,也不乏肺、结肠的双原发恶性肿瘤,但是肺癌和结肠癌同时发生基础上的各自不同部位转移却是相当罕见的。本期小文介绍一例通过EUS-FNA诊断双原发肿瘤的各自不同部位转移。
患者,男,76岁,因“乏力纳差消瘦2月余”至苏州大学附属第二医院就诊,患者在2个月内体重减轻约10kg,诉时有腹痛不适,偶有黑便,无恶心呕吐、无胸闷气急,无发热畏寒,有“高血压”、“脑梗死”病史,既往行前列腺微创手术、左肾囊肿微创手术,患者无恶性肿瘤家族史,无过敏史,无吸烟饮酒史。入院查体:脐周偏右下腹压痛,可扪及约9cm*9cm肿块,质韧,边界清,位置固定。肠镜检查发现升结肠增生性病灶,管腔狭窄,内镜无法通过(图1A),胸部增强CT提示左肺上叶尖后段见一3.1cm×2.3cm软组织肿块,边缘不光整,见多发毛刺(图1B)。肠镜活检和CT引导下肺部病灶穿刺结果均提示腺癌(图1C-D),但免疫组化证实均为原发肿瘤。其中肺部病灶:TTF1(+),NaspinA(+),CDX-2(-),CK20(-),EGFR(+),PD-L1(+,90%)。结肠病灶:TTF1(-),NapsinA(-),CDX-2(+),CK20(+),HER-2(-),Ki-67(+,80%)。结合免疫组化结果,该病人是肺部、肠道双原发的肿瘤。
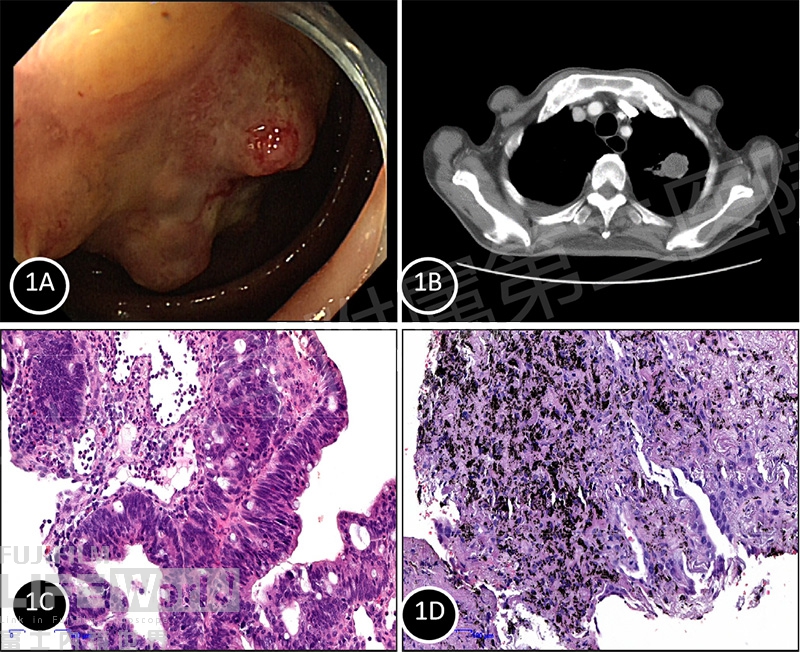
图 1 A: 升结肠病灶;B:右肺占位;C:肠病理结果(HE染色100X ); D:肺穿刺病理(HE 染色100X )
多学科会诊后考虑行全身化疗综合治疗,具体方案为:贝伐珠单抗(安维汀)+亚叶酸钙+氟尿嘧啶。先后进行了7次化疗。四个月后CT复查提示肝尾状叶,左肾上腺新发转移灶(图2)。
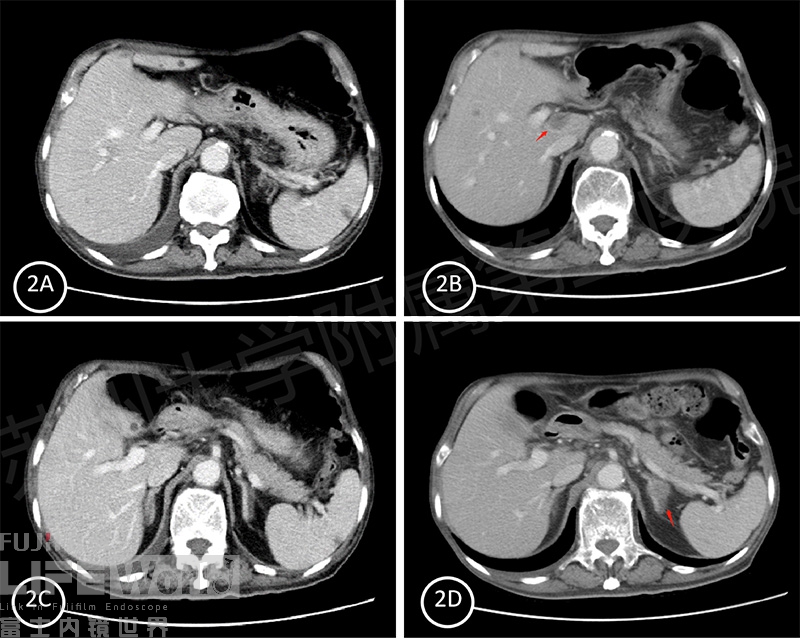
图 2 A: 初诊时肝尾状叶;B:四个月后尾状叶见转移灶(红色箭头);C:初诊时左肾上腺; D:四个月后左肾上腺见转移灶(红色箭头)
为优化化疗方案,完善EUS-FNA明确转移灶来源,采用COOK 22G穿刺针分别对肝脏和肾上腺病灶取样(视频),结果显示:肝脏标本可见腺癌,考虑肠道来源。TTF1(-),NapsinA(-),CDX-2(+),CK20(+),肾上腺可见腺癌细胞,免疫组化提示肺来源,TTF1(+),NaspinA(+),CDX-2(-),CK20(-)。(图3)。最终诊断为肺癌、肠癌伴多发肝转移、左肾上腺转移。
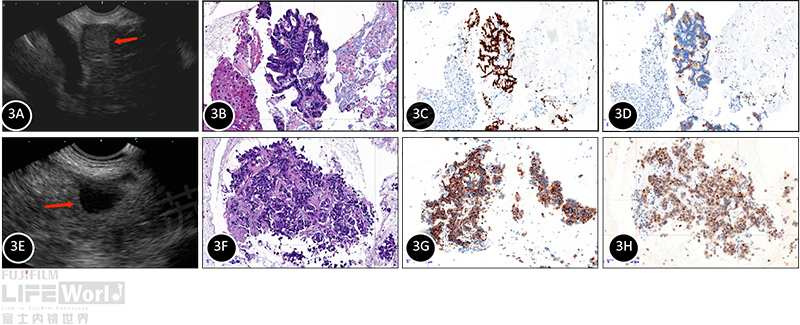
图 3 肝脏和肾上腺转移灶EUS-FNA结果(100X) A: 肝尾状叶病灶(红箭头);B:肝脏标本HE染色;C:肝脏免疫组化(CDX-2); D:肝脏免疫组化(CD20 ) E: 左肾上腺病灶(红箭头);F:肾上腺病灶HE染色;G: 肾上腺免疫组化(NapsinA);H: 肾上腺免疫组化(TTF-1)
视频
肺癌和结直肠癌均是常见恶性肿瘤。据统计,2020年全球肺癌和结直肠癌新增人数分列第二位和第三位,死亡分列第一位和第二位[1]。结直肠癌患者发生远处转移后预后较差,而其中最常见的远处转移器官是肝脏[2]。肾上腺是肺癌的常见转移部位之一,有报告指出,发生肺癌转移的患者中约有8%转移至肾上腺。
根据两种癌症的间隔时间,MPMN可分为同步MPMN(6个月以内)和异时性MPMN(6个月以上)。其中,通常以异时性MPMN多见。本例患者于初次住院明确病理诊断为肺癌和结肠癌,间隔时间小于6个月,符合同步MPMN的诊断标准。
MPMN发病机制目前尚不明确,大部分观点认为可能与机体的易感性、免疫状态、家族遗传、环境、多周期放化疗诱导的基因突变等因素有着密切的关联[15]。MPMN的治疗应基于不同肿瘤的临床分期、基因组表达谱、年龄、预期寿命和合并症等因素进行综合考量。对于异时性肿瘤,治疗路径总是包括每个单独肿瘤的序贯治疗,而对于同步肿瘤,应该在多学科讨论后制定个性化的治疗计划。在这个病例中,由于患者是同时性双原发肿瘤,并且已发生转移,我们采取了综合化疗方案。
超声内镜(EUS)引导的组织采样目前已是一项成熟的技术,除了提供胃肠道及其周围病变的诊断。还可用于基因检测以进行靶向治疗。EUS-FNA在临床上已广泛应用于评估已知原发恶性肿瘤的转移灶。在一项系列回顾中,54%的肾上腺病变经FNA确认为转移性恶性肿瘤,其中最常见是肺癌。肾上腺EUS-FNA的潜在限制是解剖学。虽然98%的病例通过经胃可以很容易地看到左肾上腺,但通过十二指肠途径辨认右肾上腺则困难重重,报告的识别率仅30%-87%。利用EUS进行肝脏FNA已应用广泛,相较于传统的经皮肝穿刺,EUS-FNA创伤更小,连续看到针尖,有助于在结合彩色血流和多普勒超声的情况下将出血风险降至最低,不良反应也更小[23]。本病例中,我们成功实施肝脏和肾上腺EUS-FNA, 免疫组化显示肾上腺病灶NapsinA(+)、TTF1(+),CDX-2(-),CK20(-)考虑为肺癌转移,而肝脏病灶CDX-2(+),CK20(+),TTF1(-),NapsinA(-)、考虑结肠癌转移。
该病例表明,针对多原发肿瘤合并多发转移,采取合适的检查方式以明确肿瘤性质和来源至关重要,对于每个肿瘤都要抽丝剥茧仔细评估,以选取综合可行的治疗方案,同时也体现了EUS-FNA诊断多原发恶性肿瘤转移的可行性与安全性。
参考文献:
[1] Sung H , Ferlay J , Siegel R , et al. Global Cancer Statistics 2020: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries[J]. CA: A Cancer Journal for Clinicians, 2021, 71(3), 209-249. DOI:10.3322/caac.21660.
[2] Manfredi S , Lepage C , Hatem C , et al. Epidemiology and management of liver metastases from colorectal cancer.[J]. Annals of Surgery, 2006, 244(2):254-259. DOI:10.1177/107602960200800303.
[3]Riihimäki M , Hemminki A , Fallah M , et al. Metastatic sites and survival in lung cancer[J]. Lung Cancer, 2014. DOI:10.1016/j.lungcan.2014.07.020.
[4] Peng YF , Gu J . Synchronous colorectal and lung cancer: Report of three cases[J]. World Journal of Gastroenterology, 2008, 14(6):5. DOI:10.3748/wjg.14.969.
[5]Lv M , Zhang X , Shen Y , et al. Clinical analysis and prognosis of synchronous and metachronous multiple primary malignant tumors[J]. Medicine (Baltimore), 2017, 96: e6799. DOI: 10.1097/MD.0000000000006799.
[6]Dranka-Bojarowska D , Lewiński A . Multiple primary cancers in patients treated for squamous cell carcinoma of the esophagus[J]. Polish Journal of Surgery, 2019, 91, 38–41. DOI: 10.5604/01.3001.0012.8371.
[7]Carlomagno , Nicola , Santangelo , et al. Rare multiple primary malignancies among surgical patients--a single surgical unit experience[J]. Ecancer medical science, 2014. DOI:10.3332/ecancer.2014.438.
[8] Mariotto AB , Rowland JH , Ries L , et al. Multiple Cancer Prevalence: A Growing Challenge in Long-term Survivorship[J]. Cancer Epidemiology Biomarkers & Prevention, 2007, 16(3):566-571. DOI:10.1158/1055-9965.EPI-06-0782
[9] Jiao F , Yao LJ , Zhou J , et al. Clinical Features of Multiple Primary Malignancies: a Retrospective Analysis of 72 Chinese Patients[J]. Asian Pacific journal of cancer prevention: APJCP, 2014, 15(1):331-334. DOI:10.7314/APJCP.2014.15.1.331.
[10] Bagri PK , Singh D , Singhal MK , et al. Double primary malignancies: a clinical & pathological analysis report from a regional cancer institute in India.[J]. Iran J Cancer Prev, 2014, 7(2):66-72. doi:4969
[11] Etiz D , Metcalfe E , Akcay M . Multiple primary malignant neoplasms: A 10-year experience at a single institution from Turkey.[J]. Journal of Cancer Research and Therapeutics, 2017, 13(1):16. DOI: 10.4103/0973-1482.183219.
[12]Jena A , Patnayak R , Lakshmi AY , et al. Multiple primary cancers: An enigma[J]. South Asian Journal of Cancer, 2016. DOI: 10.4103/2278-330X.179698.
[13] Nemes A , Todor N , Nagy V . Clinicopathological characteristics of patients with multiple primary neoplasms - a retrospective analysis[J]. Journal of B.U.ON.: official journal of the Balkan Union of Oncology, 2018, 23(6):1846-1854.
[14] Wang XK , Zhou MH . Clinical features and survival of patients with multiple primary malignancies[J]. World Journal of Clinical Cases, 2021, 9(34):10. DOI: 10.12998/wjcc.v9.i34.10484.
[15] Rondeau V , Simone Mathoulin-Pélissier , Tanneau L , et al. Separate and combined analysis of successive dependent outcomes after breast-conservation surgery: recurrence, metastases, second cancer and death[J]. BMC Cancer, 2010, 10(1):1-12. DOI:10.1186/1471-2407-10-697.
[16] Ágoston EI , Somorácz Á , Madaras L , et al. Successful treatment of three synchronous primary malignant tumours—reflection on surgical, pathological and oncological aspects and decision making[J]. Journal of Surgical Case Reports, 2018(4):4. DOI:10.1093/jscr/rjy041.
[17] Erickson RA . EUS-guided FNA[J]. 2004, 60(2):267-279. DOI:10.1016/s0016-5107(04)01529-9.
[18] Huang JY , Chang KJ . Improvements and innovations in endoscopic ultrasound guided fine needle aspiration[J]. Journal of Hepato-Biliary-Pancreatic Science, 2015, 22: E37-46. DOI:10.1002/jhbp.232.
[19] Wani S , Muthusamy VR , McGrath CM , et al. AGA White Paper: Optimizing Endoscopic Ultrasound-Guided Tissue Acquisition and Future Directions[J]. Clinical Gastroenterology and Hepatology, 2018, 16: 318-327. DOI:10.1016/j.cgh.2017.10.020.
[20] Novotny AG , Reynolds JP , Shah AA , et al. Fine-needle aspiration of adrenal lesions: A 20-year single institution experience with comparison of percutaneous and endoscopic ultrasound guided approaches[J]. Diagnostic Cytopathology, 2019, 47(10). DOI:10.1002/dc.24261
[21] Puri R , Thandassery RB , Choudhary NS , et al. Endoscopic Ultrasound-Guided Fine-Needle Aspiration of the Adrenal Glands: Analysis of 21 Patients[J]. Clinical Endoscopy, 2015, 48(2):165. DOI:10.5946/ce.2015.48.2.165.
[22] Drewelow B , Majcher-Peszynska J . Preoperative routine evaluation of bilateral adrenal glands by endoscopic ultrasound and fine-needle aspiration in patients with potentially resectable lung cancer[J]. Endoscopy, 2013, 45(03):195-201. DOI:10.1055/s-0032-1325988.
[23] Nguyen P , Feng JC , Chang KJ . Endoscopic ultrasound (EUS) and EUS-guided fine-needle aspiration (FNA) of liver lesions.[J]. Gastrointestinal Endoscopy, 1999, 45(3):357. DOI:10.1016/S0016-5107(97)80606-2.