程桂莲 吴伟 徐利明 胡端敏
EUS-FNA作为一种诊断技术,其安全性得到了广泛认可。然而,在本期经典病例中,我们将介绍一种在EUS检查下看似无害,但实际上隐藏着巨大风险的病灶---副神经节瘤。对于EUS术者,能够识别并规避这一“陷阱”具有重要意义。
副神经节瘤是一类少见的神经内分泌肿瘤,来源于由神经嵴外胚层发育而成的副神经节细胞。胚胎早期的神经嵴是交感神经母细胞和嗜铬母细胞的共同前体,随着胚胎发育,大部分嗜铬母细胞并入肾上腺髓质,另一部分嗜铬母细胞并入交感神经节及副交感神经节,形成肾上腺外嗜铬组织(副神经节系统)。出生后,随着肾上腺髓质嗜铬细胞发育成熟,肾上腺外嗜铬组织逐渐退化。在特殊情况下,可以发生肿瘤,即副神经节瘤,其中发生于肾上腺内被称为嗜铬细胞瘤,但最新WHO指南将嗜铬细胞瘤视为“肾上腺内副神经节瘤”。临床上根据有无典型症状分为无功能型、亚临床型(隐匿型)和功能型三类。功能型因为瘤体周期性释放儿茶酚胺入血,表现为阵发性或持续性高血压、心悸、头痛等症状,易于被发现;无功能型缺乏典型的临床症状,通常因肿瘤体积增大压迫邻近脏器造成腹部不适或体检发现,危害不大;亚临床型(隐匿型)虽然具有分泌儿茶酚胺的功能,但由于分泌量小,不足以引发典型的临床症状,常在术中因为牵拉刺激肿物导致血压剧烈波动,甚至出现高血压危象、急性心力衰竭及肺水肿等严重并发症,此型最危险,堪称隐形“地雷”。本中心即遇到一例隐匿型副神经节瘤,具体病例如下:
病例一
老年男性,有高血压史,未服药,平时监测血压140/90mmHg左右;13年前有右半结肠癌根治史,术后病理为中分化腺癌,侵及全层,术后化疗6次;此次常规体检腹部彩超发现“腹腔肿物”。入院CT:右腹膜后占位(右侧腹膜后见椭圆形低密度结节影,边界清晰,密度均匀,动脉期轻度强化,强化静脉期达高峰):考虑肿大淋巴结。拟行EUS-FNA,EUS示腹膜后见类圆形、边界清晰、均质低回声病变,多普勒可见内部散在血流信号,FNA细胞学可见核大异形细胞,免疫组化AE1/AE3(-),CgA(+),Syn(+),S100(+),Ki-67(+ 约3%),考虑副神经节瘤,后外科手术切除,术中血压波动显著,明确诊断为隐匿型副神经节瘤。
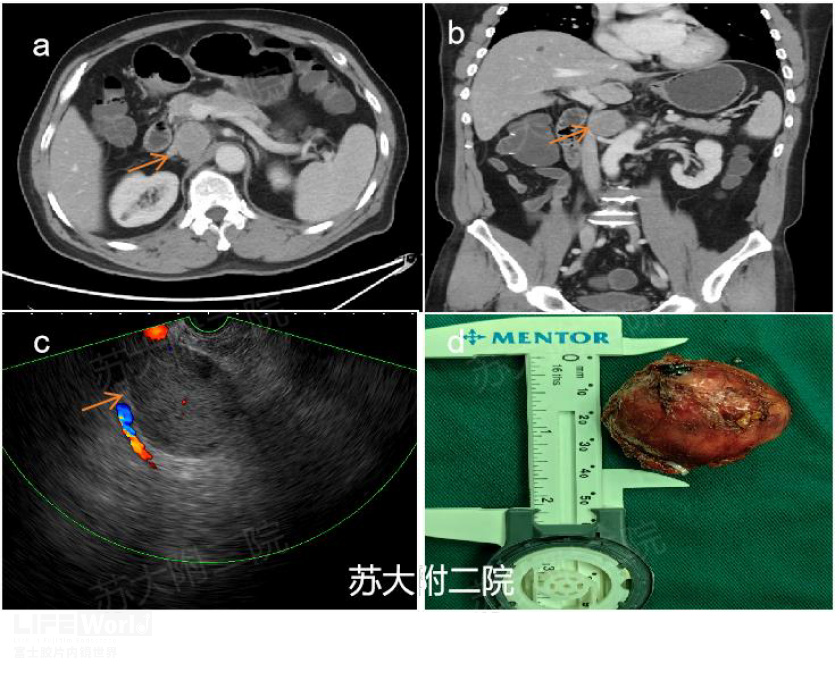
图1(a、b:横断面及冠状位CT;c:EUS示类圆形、均匀低密度病灶、点状血流信号;d:术后大体标本)
视频1
副神经节瘤可发生于全身各个部位,其中腹盆肾上腺外副神经节瘤好发于腹主动脉远端从肠系膜下动脉至髂动脉分叉水平的副神经节组织形成Zuckerkandl器,其次为膀胱壁。膀胱副神经节瘤在嗜铬细胞瘤/副神经节瘤占比不足1%,在所有膀胱肿瘤占比约0.05%~0.06%左右,80%以上膀胱副神经瘤有内分泌功能。典型临床表现是膀胱胀满时或排尿过程中出现阵发性高血压症状,如头痛、头晕、心悸、面色苍白、出汗等,甚至晕厥,排尿后症状逐渐缓解。众所周知,盆腔区域并不是EUS的主流应用区域,不像上消化道的EUS探查有血管/脉管作为路标,盆腔的EUS探查(特别是线阵EUS)对于初学者而言,往往一头雾水。此时,作为盆腔唯一实质性脏器生殖系统便是EUS在盆腔探查的坐标,相应脏器的病变便会在EUS实践中不期而遇(图2)。
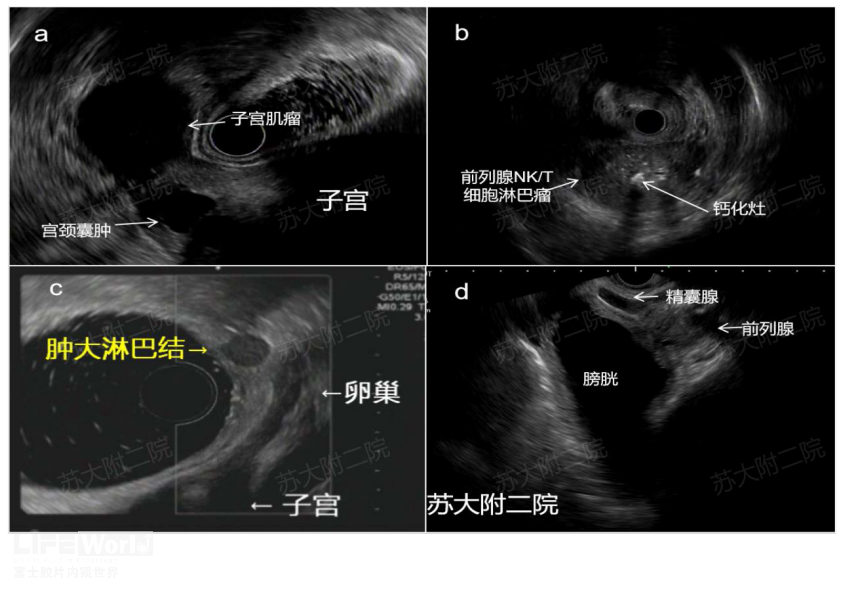
图2(a:R-eus示宫颈囊肿及宫颈后壁肌瘤;b:前列腺EUS-FNA证实NK/T细胞淋巴瘤;c:盆腔转移淋巴结经FNA证实为恶性;d:线阵EUS显示膀胱与精囊腺及前列腺的相对应位置)
在盆腔,相对于生殖器官,膀胱更靠前腹且为空腔脏器,膀胱肿物EUS-FNA是否同样安全有效呢?我们来看看最近本中心遇到的一例膀胱副神经节瘤的诊治经过,具体如下:
病例二
中年男性,既往有乙肝病史,否认其他病史,此次因腹胀入院。入院血常规: WBC 2.8*10^9,PLT 58*10^9,Hb120g/L,PT 16.7s, APTT 43.7 s,ALB 33g/L,AFP18.9ng/ml,ca199:51.U/ml,ca125:485 U/ml。CT:1.膀胱右后壁占位累及浆膜面,腹盆腔多发小淋巴结,考虑ca,建议膀胱镜检查;2.肝硬化失代偿,门静脉侧支循环形成,腹盆腔积液。 胃镜提示食道静脉曲张(图3)。腹水穿刺呈漏出液,脱落细胞学阴性。诊断乙肝后肝硬化、肝硬化失代偿明确。膀胱镜检查未见明显结石及新生物,为明确病变性质,拟行EUS-FNA,EUS示膀胱后壁见低回声病灶,回声尚均匀,多普勒未见明显血流信号(视频2),FNA抽吸时标本血凝块较多,病理提示异形细胞富含胞浆,呈嗜酸性,细胞多形性,免疫组化:AE1/AE3(-),CgA(+),Syn(+),S100(+),GATA3(+),Ki-67(+ 2%)(图4),确诊(膀胱)副神经节瘤。术后无腹痛、发热、血尿等不适。患者由于无任何症状,拒绝手术治疗,目前随访中。
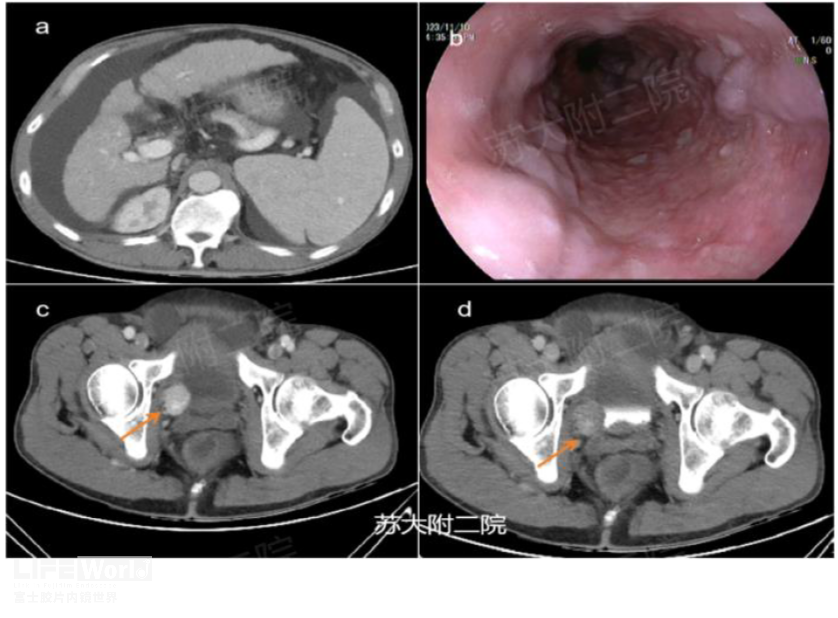
图3(a:CT示肝硬化、腹水;b:胃镜见食道静脉曲张;c、d:膀胱右后壁富血供病灶)
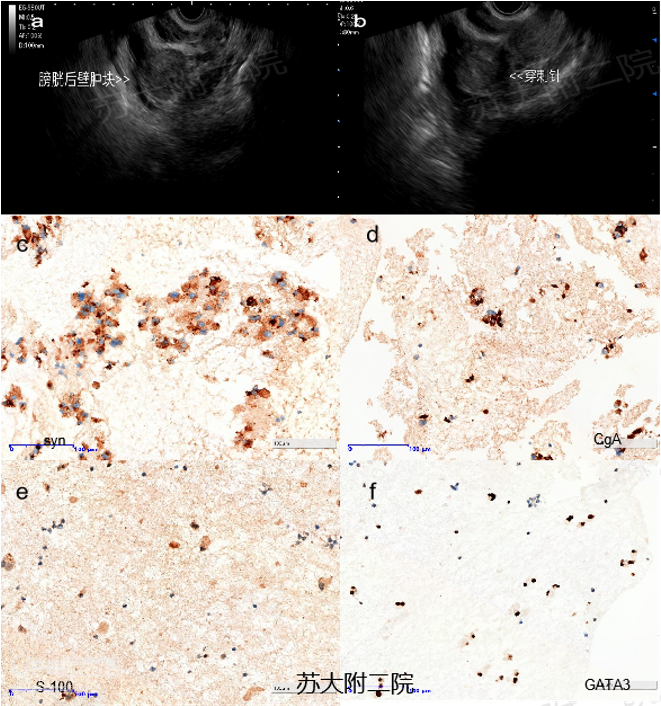
图4(a、b: EUS示膀胱右后壁均匀低回声病灶;c、d、e、f:免疫组化syn +、CgA +、s-100 +、GATA3 +)
视频2
副神经节瘤典型病理可见纤维血管间质中的细胞巢组成,称为“细胞球(Zellballen)”,巢内肿瘤细胞种类不同,可由大的多角形神经样细胞、丰富的颗粒状嗜碱性胞质,圆形嗜酸性、嫌色或嗜双色上皮样细胞组成。然而,这些特征常见于具有组织结构的活检/大体标本。而FNA细胞学常提示肿瘤细胞核呈圆形/多角形,胞浆丰富,核仁明显,可见核异形(图5)。故而,单纯依靠细胞学形态特征导致的误诊并不足为奇。 Murat K等学者2004年首次在GIE上报道的EUS诊断腹膜后囊性副神经节瘤,由于患者FNA术后出现高血压危象,最终结合CT、EUS及临床表现,考虑副神经节瘤,最后通过手术切除标本证实为副神经节瘤,文中FNA细胞学也仅提供了肿瘤的线索而非确诊(图6)。 不仅如此,2021年,Gandhi等人回顾性分析了至今Pubmed发表的47例胰腺副神经节瘤,其中15例术前行EUS-FNA病例中,仅6例明确诊断为副神经节瘤,其余9例被误诊为胰腺NET、胰腺导管腺癌及梭形细胞瘤等。文中作者分析,被误诊往往是因为组织量不够/其他因素未能行免疫组化所致。因此,确诊副神经节瘤一定需通过免疫组化CgA、SYN、S-100等阳性方能得以证实。
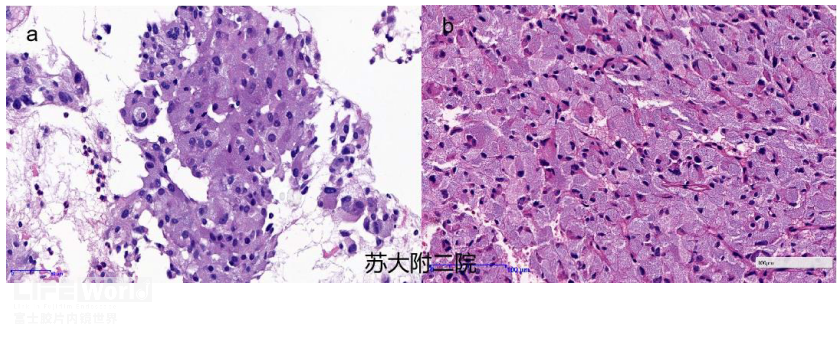
图5(a:FNA HE病理;b大体标本HE)
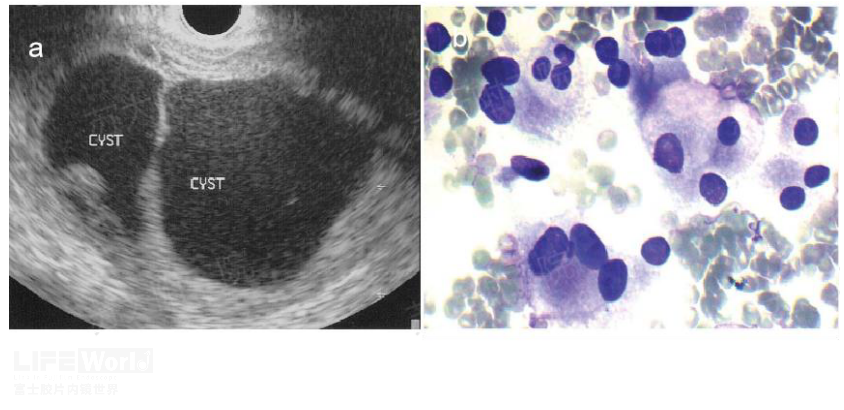
图6(a:EUS下后腹膜双囊性病灶;b:FNA细胞学提示核大异形细胞,考虑肿瘤;图片来自文献Retroperitoneal paraganglioma: EUS appearance and risk associated with EUS-guided FNA)
尽管目前文献报道,副神经节瘤FNA/FNB过程中发生高血压危象的概率不高。但对于高龄、合并症多患者,高血压危象识别或处理不及时,将会带来致命危险。故而,明确副神经节瘤时往往不建议FNA/FNB。但隐匿型副神经节瘤,无明显临床症状,特征性影像主要表现在血供丰富,早期强化明显。对于非常见部位,如胰腺、胆囊及十二指肠区域的血供丰富病灶,往往还需与casetleman病、间质瘤、神经内分泌肿瘤、纤维鞘瘤、肉瘤、转移瘤等鉴别。此时,FNA/FNB便不可避免,如何在围手术期保障患者安全及诊断准确性,是操作的重中之重。对于富血供病例的FNA/FNB,笔者结合文献及经验,总结如下:1)术前:详细询问病史,阅读影像(必要时与影像科医生共同约阅片力求寻找诊断的蛛丝马迹),尽可能完善检查如(血压监测、心电图、IgG4等,高度怀疑副神经节瘤时建议术前24小时检测血尿甲氧基肾上腺素及甲氧基去甲肾上腺素),开通静脉通路,备急救设施(α及β1-受体阻滞剂、利尿剂、激素、气管插管等);2)术中:穿刺过程中应持续监测血压、心率、心电图。富血供病例穿刺出血风险高且单纯细胞学无法达到准确诊断。此时,既要尽可能规避因出血量大被迫停止穿刺,又需获取充分的组织条行免疫组化。故而,建议可选择22/25g的FNA/FNB穿刺针,从微负压/小负压开始,同时充分利用ROSE及MOSE的优势指导穿刺进程。3)术后:术后 24- 48 h 密切监测患者的血压和心率,观察血红蛋白变化及有无腹痛、头痛等表现。
随着内镜技术的发展,EUS及相关技术在临床中的适应症也越来越广泛。副神经节瘤虽罕见,但不能保证业务不断拓展过程中不会偶遇,一旦遇见又不巧触“雷”,炸的不仅仅是病人的安危,还有医生的信心。行医之路如临深渊,如履薄冰,谨此小文,希望有助于同仁避“雷”。
参考文献
1. Mete O, Asa SL, Gill AJ, Kimura N, de Krijger RR, Tischler A. Overview of the 2022 WHO Classification of Paragangliomas and Pheochromocytomas. Endocr Pathol. 2022;33(1):90-114.
2. Lee KY, Oh YW, Noh HJ, et al. Extraadrenal paragangliomas of the body: imaging features. AJR Am J Roentgenol. 2006;187(2):492-504.
3. Sharma SS, Jhajharia A, Maharshi S, Ram S, Shankar V, Katiar P. Mediastinal paraganglioma: specific endoscopic ultrasound features. Endosc Ultrasound
4. Lanke G, Stewart JM, Lee JH. Pancreatic paraganglioma diagnosed by endoscopic ultrasound-guided fine needle aspiration: A case report and review of literature. World J Gastroenterol. 2021;27(37):6322-6331.
5. Kubota K, Kato S, Mawatari H, et al. Risky endoscopic ultrasonography-guided fine-needle aspiration for asymptomatic retroperitoneal tumors. Dig Endosc. 2010;22(2):144-146
6. Akdamar MK, Eltoum I, Eloubeidi MA. Retroperitoneal paraganglioma: EUS appearance and risk associated with EUS-guided FNA. Gastrointest Endosc. 2004;60(6):1018-1021
7. Özkul N, Kann PH. Pheochromocytoma and Adrenocortical Carcinoma: Morphological Characteristics in Endoscopic Ultrasound Imaging. Ultrasound Int Open. 2021;7(2):E64-E70.
8. Petrelli F, Fratini G, Sbrozzi-Vanni A, et al. Peripancreatic paraganglioma: Lesson from a round table. World J Gastroenterol. 2022;28(21):2396-2402.
9. Yang SX, Dogra VS, Kothari TH, Reyes MCD. Metastatic pheochromocytoma to the pancreas diagnosed by endoscopic ultrasound-guided fine needle aspiration: A case report and review of literature. Diagn Cytopathol. 2020;48(3):217-221
10. 朱正,赵心明,戴景蕊,等.腹膜后异位嗜铬细胞瘤的 CT 和 MR 表现[J].中华肿瘤杂志, 2015, 37(3):5
11. 曾正陪.嗜铬细胞瘤和副神经节瘤诊断治疗专家共识(2020版)[J].中华内分泌代谢杂志, 2020, 36(9):14.